题目内容
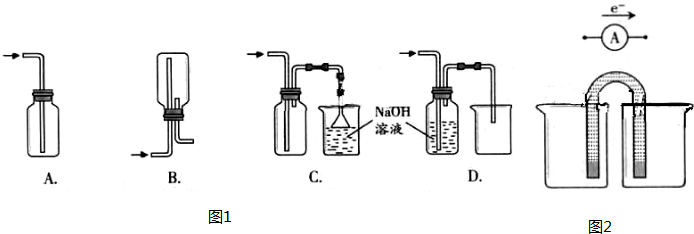
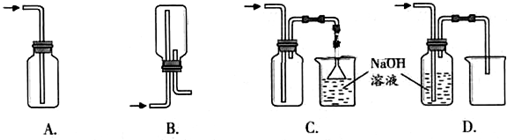
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.(1)如图1在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验.
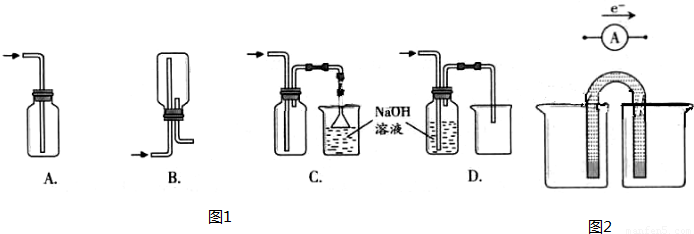
①下列收集Cl2的正确装置是 .
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 .
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
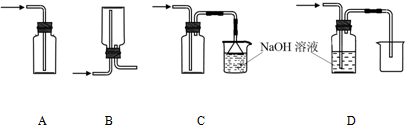
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能.设计两种类型的原电池,探究其能量转化效率.
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线.
①完成原电池的甲装置示意图(如图2),并作相应标注.
要求:在同一烧杯中,电极与溶液含相同的金属元素.
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 .
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 .
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极.
【答案】分析:(1)①氯气是比空气重的可溶于水的气体,依据氯气物理性质和装置分析;
②氯气和水反应生成盐酸和次氯酸;依据平衡状态各物质性质分析判断
③依据氯气具有氧化性能氧化溴离子为溴单质,溴单质在四氯化碳中溶解度大,据此现象分析判断设计实验;
(2)①依据原电池原理和盐桥的作用,在同一烧杯中,电极与溶液含相同的金属元素,设计不同的电极为铜和锌,电解质溶液为硫酸铜和硫酸锌溶液;
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,则另一电极应比铜活泼做负极;
③从电硫稳定,能量转化彻底,反应速率快等分析判断;
(3)牲阳极的阴极保护法原理是原电池中把被保护的金属设计成正极,另一活泼的金属做负极.
解答:解:(1)①氯气是比空气中的可溶于水水的有毒气体;
A、导气管位置正确,因为氯气比空气重用向上排气方法,但只有进气口,无出气口,无法排出气体,故A错误;
B、此装置是用来收集比空气轻的气体,若收集氯气,需要短进长出,故B错误;
C、装置长进短出可以收集比空气重的气体氯气,剩余的氯气有毒需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,故C正确;
D、氯气通入去海南溶液会发生反应.氯气被氢氧化钠吸收,不能收集到氯气,故D错误;
故答案为:C;
②将Cl2通入水中,发生反应Cl2+H2O=HCl+HClO,所得溶液中具有氧化性的含氯粒子为Cl2 HClO ClO-;
故答案为:Cl2、HClO、ClO-;
③氯气具有氧化性能氧化溴离子为溴单质,溴单质在四氯化碳中溶解度大,可以加入溴化钠溶液,充分振荡反应,Cl2+2Br-=2Cl-+Br2,静置后溴溶于下层的四氯化碳层呈橙色;
故答案为:加入适量的NaBr溶液,充分振荡,静置.溶液分层,同时下层液体颜色为橙色;
(2)①在同一烧杯中,电极与溶液含相同的金属元素,如图示设计原电池,锌做负极,铜做正极,原电池的甲装置示意图为: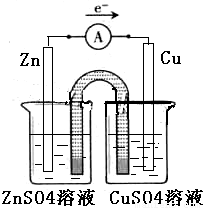
故答案为: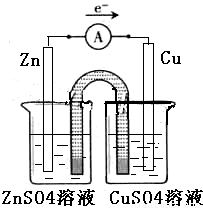 ;
;
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,依据原电池反应的原理,需要选用比铜活泼的锌做负极,下层原电池,负极发生氧化反应,Zn-2e-=Zn2+,锌溶解,故答案为:溶解;
③甲乙两种原电池中可更有效地将化学能转化为电能的是甲,因为甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能,故答案为:甲,甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能;
(3)根据牺牲阳极的阴极保护法原理,是原电池原理的应用,利用被保护的金属做正极被保护选择,为减缓电解质溶液中铁片的腐蚀,应选择比铁活泼的金属做负极,在电池内电路为阳极,称为牺牲阳极的阴极保护法,材料中 选择锌做阳极,故答案为:Zn.
点评:本题考查了气体收集方法,离子检验试验设计,原电池装置设计,盐桥的作用分析应用,金属保护的方法和名称,题目难度中等.
②氯气和水反应生成盐酸和次氯酸;依据平衡状态各物质性质分析判断
③依据氯气具有氧化性能氧化溴离子为溴单质,溴单质在四氯化碳中溶解度大,据此现象分析判断设计实验;
(2)①依据原电池原理和盐桥的作用,在同一烧杯中,电极与溶液含相同的金属元素,设计不同的电极为铜和锌,电解质溶液为硫酸铜和硫酸锌溶液;
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,则另一电极应比铜活泼做负极;
③从电硫稳定,能量转化彻底,反应速率快等分析判断;
(3)牲阳极的阴极保护法原理是原电池中把被保护的金属设计成正极,另一活泼的金属做负极.
解答:解:(1)①氯气是比空气中的可溶于水水的有毒气体;
A、导气管位置正确,因为氯气比空气重用向上排气方法,但只有进气口,无出气口,无法排出气体,故A错误;
B、此装置是用来收集比空气轻的气体,若收集氯气,需要短进长出,故B错误;
C、装置长进短出可以收集比空气重的气体氯气,剩余的氯气有毒需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,故C正确;
D、氯气通入去海南溶液会发生反应.氯气被氢氧化钠吸收,不能收集到氯气,故D错误;
故答案为:C;
②将Cl2通入水中,发生反应Cl2+H2O=HCl+HClO,所得溶液中具有氧化性的含氯粒子为Cl2 HClO ClO-;
故答案为:Cl2、HClO、ClO-;
③氯气具有氧化性能氧化溴离子为溴单质,溴单质在四氯化碳中溶解度大,可以加入溴化钠溶液,充分振荡反应,Cl2+2Br-=2Cl-+Br2,静置后溴溶于下层的四氯化碳层呈橙色;
故答案为:加入适量的NaBr溶液,充分振荡,静置.溶液分层,同时下层液体颜色为橙色;
(2)①在同一烧杯中,电极与溶液含相同的金属元素,如图示设计原电池,锌做负极,铜做正极,原电池的甲装置示意图为:

故答案为:
 ;
;②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,依据原电池反应的原理,需要选用比铜活泼的锌做负极,下层原电池,负极发生氧化反应,Zn-2e-=Zn2+,锌溶解,故答案为:溶解;
③甲乙两种原电池中可更有效地将化学能转化为电能的是甲,因为甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能,故答案为:甲,甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能;
(3)根据牺牲阳极的阴极保护法原理,是原电池原理的应用,利用被保护的金属做正极被保护选择,为减缓电解质溶液中铁片的腐蚀,应选择比铁活泼的金属做负极,在电池内电路为阳极,称为牺牲阳极的阴极保护法,材料中 选择锌做阳极,故答案为:Zn.
点评:本题考查了气体收集方法,离子检验试验设计,原电池装置设计,盐桥的作用分析应用,金属保护的方法和名称,题目难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.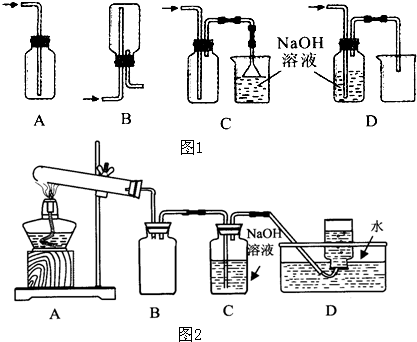
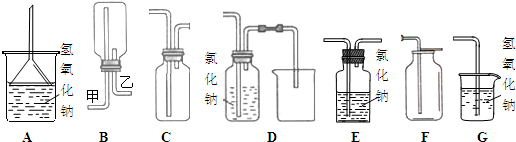
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验,如图1所示.
①写出该反应的离子方程式 ;
②下列收集Cl2的装置正确装置是 ;
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 ;
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, .
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验.
用如图2所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是 .
②经小组讨论并验证该无色气体为O2,其验证方法是 .
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:ⅠAg;ⅡAg2O;ⅢAg和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
【实验评价】根据上述实验,③不能确定固体产物成分的实验是 (填实验编号).
【实验结论】根据上述实验结果,④该小组得出的AgNO3固体热分解的化学方程式为 .

(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验,如图1所示.
①写出该反应的离子方程式
②下列收集Cl2的装置正确装置是
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验.
用如图2所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是
②经小组讨论并验证该无色气体为O2,其验证方法是
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:ⅠAg;ⅡAg2O;ⅢAg和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,④该小组得出的AgNO3固体热分解的化学方程式为