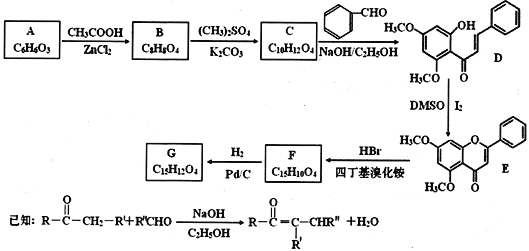
题目内容
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:2LaC13+6NH4HCO3= La2(CO3)3↓+6NH4Cl+ 3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
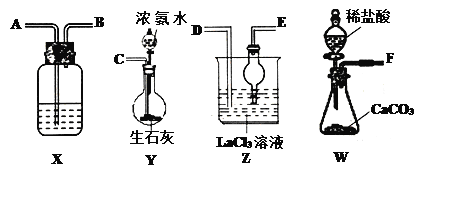
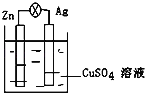
(l)盛放稀盐酸的仪器名称为____________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→___→___ →___ →___ →___ 。
(3)Y中发生反应的化学反应式为________________。
(4)X中盛放的试剂是_____,其作用为________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________。
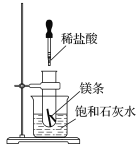
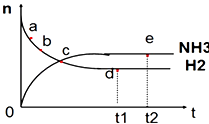
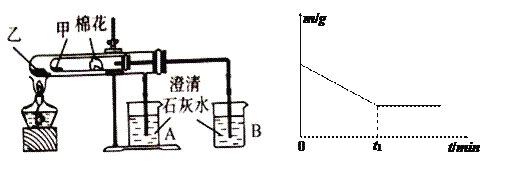
(6)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为_______;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为_______________________。
【答案】 分液漏斗 A B D E C NH3·H2O+CaO= Ca(OH)2+NH3↑或NH3·H2O ![]() NH3+H2O 饱和NaHCO3溶液 除去CO2中的HCl NH3在水的溶解度大 La(HCO3)3 B中澄清石灰水先变混浊,A中后变混浊
NH3+H2O 饱和NaHCO3溶液 除去CO2中的HCl NH3在水的溶解度大 La(HCO3)3 B中澄清石灰水先变混浊,A中后变混浊
【解析】(l)盛放稀盐酸的仪器名称为分液漏斗;正确答案:分液漏斗。
(2)装置W产生二氧化碳,通过装置X除去氯化氢,进入到装置Z中;装置Y产生氨气,进入装置Z中,且要防倒吸,因此要连接E;综上,制备碳酸镧实验流程中导管从左向右的连接顺序为: A →B → D →E → C;正确答案:A B D E C。
(3)Y中为浓氨水与生石灰反应产生氨气,发生反应的化学反应式为NH3·H2O+CaO= Ca(OH)2+NH3↑或NH3·H2O ![]() NH3+H2O;正确答案:NH3·H2O+CaO= Ca(OH)2+NH3↑或NH3·H2O
NH3+H2O;正确答案:NH3·H2O+CaO= Ca(OH)2+NH3↑或NH3·H2O ![]() NH3+H2O。
NH3+H2O。
(4)X中盛放的试剂的作用是为了除去二氧化碳气体中氯化氢气体,需要用饱和NaHCO3溶液;正确答案:饱和NaHCO3溶液;除去CO2中的HCl。
(5)Z中应先通入NH3,后通入过量的CO2,原因为NH3在水的溶解度大,二氧化碳在水中的溶解度较小,但是在氨水中溶解度较大。这样操作可以得到浓度较大的碳酸氢铵溶液,提高反应速率和碳酸镧的产率;正确答案:NH3在水的溶解度大。
(6)一般正盐的稳定性强于对应的酸式盐,所以欲探究La2(CO3)3和La(HCO3)3的稳定性强弱,可以在相同温度下探究两者的稳定性,也可以给正盐更高的温度加热进行探究。若设计题中的实验装置,则甲试管中盛放的物质受热温度较低,应为La(HCO3)3;根据乙试管中固体质量与灼烧时间的关系曲线可知,碳酸镧在一定温度下会发生分解,所以碳酸氢镧一定在更低的温度下发生分解,所以实验过程中可以观察到的现象为B中澄清石灰水先变混浊,A中后变混浊;正确答案:La(HCO3)3;B中澄清石灰水先变混浊,A中后变混浊。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案