题目内容
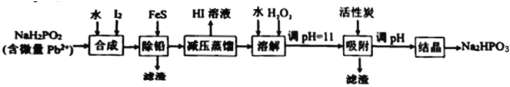
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
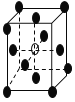
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为___________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为___________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用是___________。
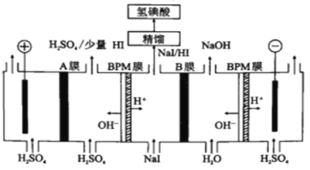
(5)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
①B膜最佳应选择___________
②阳极的电极反应式是___________。
③少量的I-因为浓度差通过BPM膜,若撤去A膜,其缺点是:___________
【答案】NaH2PO2+I2+H2O=H3PO3+NaI+HI FeS(s)+Pb2+(aq)=PbS(s)+Fe2+(aq) NaH2PO3 除去铁,并将NaH2PO3转变为Na2HPO3 Na+离子交换膜 2H2O-4e-=O2↑+4H+ I-会在阳极放电,沉积在阳极表面,损伤阳极板
【解析】
“合成”步骤,NaH2PO2和I2和水反应生成H3PO3和NaI和HI;之后加入FeS将Pb2+转化为PbS除去,此时溶液中的杂质为Fe2+;因为HI易挥发,“减压蒸馏”获得HI溶液,剩余固体主要为含有Fe2+杂质的NaH2PO3,加水溶解,再加入H2O2将Fe2+氧化成Fe3+,调pH=11将Fe3+转化为沉淀除去,同时部分NaH2PO3转换为了Na2HPO3;再次调pH将NaH2PO3彻底转化为Na2HPO3,最后“结晶”得到Na2HPO3固体,据此分析解答。
(1)根据后续流程可知“合成”步骤中产生HI,说明I2将NaH2PO2氧化,HI为强酸,所以还生成H3PO3和NaI,根据电子守恒和元素守恒可得该反应的化学方程式为:NaH2PO2+I2+H2O= H3PO3+NaI+HI;
(2)“除铅”过程,利用沉淀转化原理,加入FeS将Pb2+变成PbS,离子方程式为:FeS(s)+Pb2+(aq)=Fe2+(aq)+PbS(s);
(3)根据合成步骤的反应,可知蒸馏前溶液中主要含H3PO3、NaI和HI,而蒸馏过程I-回收率为95%,说明H3PO3和NaI反应有NaH2PO3生成,则剩余固体的主要成分为NaH2PO3;
(4)“调pH=11”的作用:将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3;
(5)①从图上看,右端的BPM膜和B膜之间产生NaOH,BPM膜提供OH-,所以B膜最好是钠离子交换膜;
②阳极附近溶液为硫酸溶液,水电离的氢氧根失电子产生氧气,同时产生氢离子,故阳极的电极反应式为:2H2O-4e-=O2↑+4H+;
③电解池中阴离子有向阳极移动的趋势,少量的I-因为浓度差通过BPM膜,若没有A膜的阻挡,I-会在阳极失电子得到碘单质,沉积在阳极表面,损伤阳极板。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号)_________,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:___________________________________;
(4)如下图是某次滴定时的滴定管中的液面,其读数为_________mL

(5)根据下列数据:请计算待测盐酸溶液的浓度:_______________________mol·L-1
滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |