题目内容
4.下列关于电解质溶液的叙述正确的是( )| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | pH相同的盐酸和醋酸溶液,加水稀释100倍后两溶液pH仍相同 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 25℃,将pH=5的盐酸稀释1000倍后,溶液的pH=8 |
分析 A、pH相差2,氢离子浓度相差100倍,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍;
B、盐酸是强酸,醋酸是弱酸,加水稀释促进弱酸的电离,加水稀释时醋酸溶液中氢离子物质的量增大,盐酸溶液中氢离子物质的量不变,据此分析;
C、盐酸和醋酸与氢氧化钠反应,均按1:1反应;
D、酸溶液无限稀释,只能是pH接近7.
解答 解:A、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍,故A正确;
B、将等pH的盐酸溶液和醋酸溶液稀释相同的倍数,加水稀释促进醋酸的电离,醋酸溶液的PH变化小,所以稀释后pH:盐酸>醋酸,故B错误;
C、盐酸和醋酸与氢氧化钠反应,均按1:1反应,HCl与CH3COOH的物质的量不相等,所以消耗的氢氧化钠的物质的量不相等,故C错误;
D、酸溶液无限稀释,只能是pH接近7,不能超过7,故D错误,
故选A.
点评 本题主要考查的是pH的比较与计算、溶液的稀释,难度不大.

练习册系列答案
相关题目
15.有人制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.以下判断错误的是( )
| A. | 电池的正极发生的反应:O2+4e-═2O2- | |
| B. | 负极发生的反应:CH4+4O2--8e-═CO2+2H2O | |
| C. | 固体电解质里的O2-的移动方向:由正极流向负极 | |
| D. | 向外电路释放电子的电极:正极(电子由正极流向负极) |
12.图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是( )
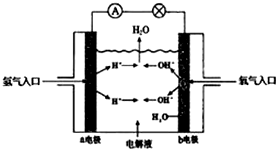

| A. | a电极是正极 | |
| B. | b电极的电极反应为:4OH--4e-=2H2O+O2 | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 氢氧燃料电池是一种具有应用前景的绿色电源 |
19. 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),△H<0,在673K、30Mpa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点c处反应达到平衡 | |
| B. | 点a的正反应速率比点b的大 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其它条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小 |
9.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )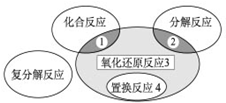

| A. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | D. | Zn+H2SO4═ZnSO4+H2↑ |
16.下列物质属于同系物的一组是( )
| A. | CH4与C2H4 | B. | 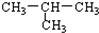 与 CH3-CH2-CH2-CH3 与 CH3-CH2-CH2-CH3 | ||
| C. | C2H6与C3H8 | D. | C2H4与C3H6 |
13.下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把表中各反应的相应图象的序号填入表中.


| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通过量CO2 | |
| AlCl3溶液 | 通过量NH3 | |
| MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | |
| AlCl3溶液 | 逐滴加NaOH溶液至过量 | |
| 含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | |
| FeCl3溶液 | 逐滴加NaOH溶液至过量 |