题目内容
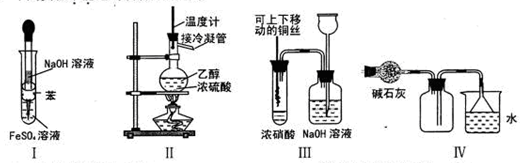
Ⅰ. 在实验室利用下列装置,可制备某些气体并验证其化学性质。
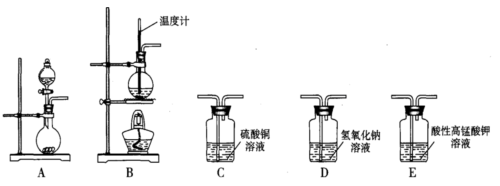
完成下列表格:
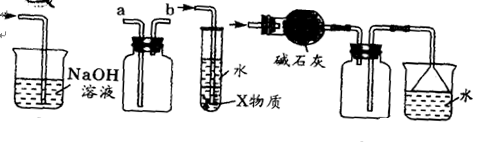
Ⅱ. 某学习小组设计实验测定电石样品的纯度。
经查阅有关资料得知H2S、PH3能与硫酸铜溶液反应,相关仪器和药品装置图如下:
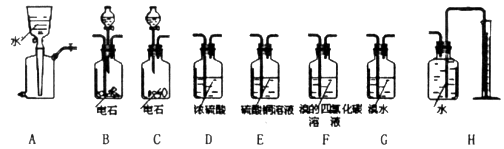
(1)按气体从左到右的流向选择最佳的装置组合是(选填字母序号):_________
(2)为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是________________。
(3)若电石样品的质量为m1g,F吸收乙炔前后的质量差为m2g,则电石样品中CaC2质量分数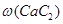 =_______________。
=_______________。

完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | _________________ | _________________ |
| (2) | 乙炔 | A→C→E | _________________ |
经查阅有关资料得知H2S、PH3能与硫酸铜溶液反应,相关仪器和药品装置图如下:

(1)按气体从左到右的流向选择最佳的装置组合是(选填字母序号):_________
(2)为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是________________。
(3)若电石样品的质量为m1g,F吸收乙炔前后的质量差为m2g,则电石样品中CaC2质量分数
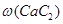 =_______________。
=_______________。(12分,每空2分)Ⅰ.(1)B→D→E 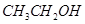
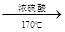
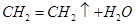
(2)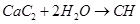
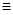
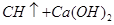
Ⅱ. (1)A、B、D、E、F;(2)饱和食盐水 (3)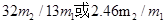
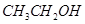
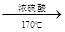
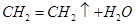
(2)
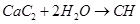
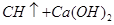
Ⅱ. (1)A、B、D、E、F;(2)饱和食盐水 (3)
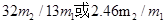
试题分析:Ⅰ.①实验室制取乙烯利用的是乙醇在浓硫酸的作用下加热到170℃通过消去反应制备乙烯。由于生成的乙烯中含有SO2,所以在通过酸性高锰酸钾溶液检验乙烯的性质之前,要首先除去SO2,所用试剂是氢氧化钠溶液,即连接顺序是B→D→E ,反应的方程式是
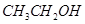
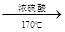
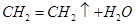 。
。②实验室制取乙炔,利用的是电石和饱和食盐水反应制备,反应的方程式是
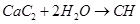
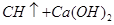 。
。Ⅱ. (1)测定电石样品的纯度,则可以通过测量电石与水反应生成的乙炔来完成。由于乙炔能被溴的四氯化碳溶液吸收,通过称量反应前后的质量即可得出生成的乙炔质量。但由于生成的乙炔气体中含有H2S和PH3,所用需要分别通过浓硫酸和硫酸铜除去。又因为装置中含有没有被完全排出的气体,因此还需要借助于A装置,因此正确的连接顺序是A、B、D、E、F。
(2)为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是饱和食盐水。
(3)F吸收乙炔前后的质量差为m2g,则生成的乙炔质量就是m2g,所用根据方程式可知碳化钙的质量是
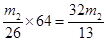 ,因此电石样品中CaC2质量分数
,因此电石样品中CaC2质量分数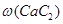 =
=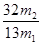 。
。点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目