题目内容
【题目】用含锌废渣(主要含Zn以及少量S、Fe、Mn、Cd等)制取氧化锌(ZnO)的工艺流程如图
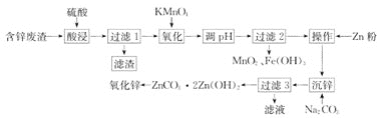
回答下列问题:
(1)“酸浸”时,锌、铁的浸出率如图(a)所示,应控制浸取终点的pH为________。
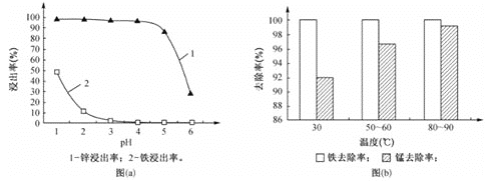
(2)“氧化”时,Fe2+、Mn2+去除率与温度的关系如图(b)所示,相同条件下还原性较强的是________(填“Fe2+”或“Mn2+”),Fe2+被KMnO4氧化生成Fe3+和MnO2的离子方程式为________。
(3)加Zn粉“操作”的目的是________。
(4)“沉锌”的离子方程式为________,由碱式碳酸锌制备轻质氧化锌的方法是________。
【答案】4(填4~5之间数据均给分) Fe2+ 3Fe2++MnO4-+4H+![]() 3Fe3++MnO2↓+2H2O 除去Cd 3Zn2++5CO32-+4H2O=ZnCO3·2Zn(OH)2↓+4HCO3-或3Zn2++3CO32-+2H2O= ZnCO3·2Zn(OH)2↓+2CO2↑ 高温焙烧
3Fe3++MnO2↓+2H2O 除去Cd 3Zn2++5CO32-+4H2O=ZnCO3·2Zn(OH)2↓+4HCO3-或3Zn2++3CO32-+2H2O= ZnCO3·2Zn(OH)2↓+2CO2↑ 高温焙烧
【解析】
(1)“酸浸”过程是为了浸出锌,据此结合图像中锌、铁的浸出率与pH的关系确定答案;
(2)根据氧化时Fe2+和Mn2+去除率的大小分析其还原性强弱;根据得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
(3)加锌粉是为了除去Cd;
(4)“沉锌”过程中反应生成ZnCO3·2Zn(OH)2,据此写出反应的离子方程式;由ZnCO3·2Zn(OH)2获得ZnO应通过高温焙烧操作。
(1)此流程是为了制取氧化锌,因此“酸浸”过程中是为了浸出锌,而不浸出铁,由图中锌铁的浸出率可知,当pH在4~5时,锌的浸出率最高,铁的浸出率几乎为0;因此应控制浸取液终点的pH为4~5;
(2)由图b可知,反应过程中,Fe2+的去除率高于Mn2+, 因此说明相同条件下,Fe2+的还原性强于Mn2+;KMnO4将Fe2+氧化为Fe3+,自身还原为MnO2,过程中Mn由+7价变为+4价,得到3个电子,Fe由+2价变为+3价,失去1个电子,根据得失电子守恒可得,Fe2+、Fe3+的系数为3,MnO4-、MnO2的系数为1;由电荷守恒可得,反应物中含有4个H+;由氢原子守恒可得,生成物中含有H2O,且其系数为2;因此可得该反应的离子方程式为:3Fe2++MnO4-+4H+=3Fe3++MnO2↓+2H2O;
(3)加锌粉是为了除去Cd;
(4)“沉锌”过程中反应生成ZnCO3·2Zn(OH)2,该反应的离子方程式为: 3Zn2++5CO32-+4H2O=ZnCO3·2Zn(OH)2↓+4HCO3-或3Zn2++3CO32-+2H2O=ZnCO3·2Zn(OH)2↓+2CO2↑;由于ZnCO3·2Zn(OH)2受热易分解,形成ZnO,因此由碱式碳酸锌制备轻质氧化锌,可采用高温焙烧操作。

【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
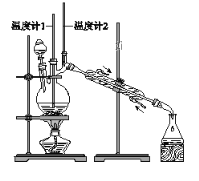
利用下图装置用正丁醇合成正丁醛。相关数据如下:
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物