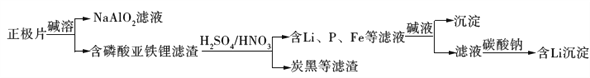
题目内容
【题目】有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A:___________________________。
C:___________________________。
【答案】(1)淀粉溶液 葡萄糖溶液 蔗糖溶液
(2)(C6H10O5)n+nH2O![]() nC6H12O6
nC6H12O6
淀粉 葡萄糖
C12H22O11+H2O![]() C6H12O6+C6H12O6
C6H12O6+C6H12O6
蔗糖 葡萄糖 果糖
【解析】三种物质中,葡萄糖能发生银镜反应,淀粉遇I2变蓝色,蔗糖能发生水解反应,且水解产物能发生银镜反应,因此A为淀粉溶液,B为葡萄糖溶液,C为蔗糖溶液。

【题目】下列实验操作、现象和得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有 |
B | 向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 |
|
C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰焰色为紫色 | 原溶液中一定只含 |
D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见砖红色沉淀生成 | 淀粉未发生水解 |
A. A B. B C. C D. D
【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
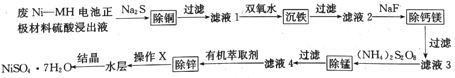
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
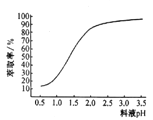
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
③“操作X”的名称是________________。