题目内容
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
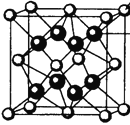
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
【答案】
(1)①1s22s22p63s1或[Ne]3s1 ②Cl
(2)H2S分子间不存在氢键,H2O分子间存在氢键
(3)平面三角形
(4)Na+
(5)K2Cr2O7+3H2O2+ 4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O
【解析】
试题分析:根据题意知M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层p轨道数是s轨道电子数的2倍,则M是O元素;R是同周期元素中最活泼的金属元素,则R是Na元素;X和M形成的一种化合物是形成酸雨的主要大气污染物,则X是S元素,Y为Cl元素;Z的基态原子4s和3d轨道半充满,即价电子排布式为3d54s1,Z是Cr元素,据此作答。
(1)R是Na元素,原子序数为11,根据构造原理确定其基态原子的电子排布式为1s22s22p63s1或[Ne]3s1;S和Cl比较电负性较大的是Cl元素,答案为:1s22s22p63s1;Cl。
(2)H2S的沸点低于H2O的主要原因是水分子间形成氢键,使水的沸点升高,答案为:H2S分子间不存在氢键,H2O分子间存在氢键。
(3)SO3中硫原子的价层电子对为3+(6-3×2)/2=3,没有孤电子对,硫原子的杂化方式为sp2,该分子的空间构型为平面三角形,答案为:平面三角形。
(4)根据晶胞结构可以算出白球的个数为![]() ,黑球的个数为8个,由于这种离子化合物的化学式为Na2O,黑球代表的是Na+,答案为:Na+。
,黑球的个数为8个,由于这种离子化合物的化学式为Na2O,黑球代表的是Na+,答案为:Na+。
(5)根据题意知重铬酸钾被还原为Cr3+,则过氧化氢被氧化生成氧气,利用化合价升降法配平,反应的化学方程式为:K2Cr2O7+3H2O2+ 4H2SO4=== K2SO4+Cr2(SO4)3+3O2↑+7H2O ,
答案为:K2Cr2O7+3H2O2+ 4H2SO4=== K2SO4+Cr2(SO4)3+3O2↑+7H2O 。

【题目】某化学兴趣小组利用下图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题

(1)写出合成乙酸乙酯的化学方程式____________________________________。
(2)仪器b的名称________,图中起冷凝回流作用的是______(填a、b、c、d、e)。
(3)为了提高乙酸乙酯的产率可采取的措施 ___________________________________
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏
物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有________________杂质。