题目内容
13.相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)?3W(g)+2Z(g)△H=-Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表:| X | Y | W | Z | 反应体系能量变化 | |
| 甲 | 2mol | 1mol | 放出akJ/mol | ||
| 乙 | 1mol | 1mol | 放出b kJ/mol | ||
| 丙 | 2mol | 2mol | 放出c kJ/mol | ||
| 丁 | 3mol | 2mol | 吸收d kJ/mol |
| A. | c+d<Q | |
| B. | 平衡时,甲、丁容器中X、W的转化率之和等于1 | |
| C. | 平衡时丙容器中Z的物质的量浓度最大 | |
| D. | X的转化率为:甲<乙<丙 |
分析 A.甲丁属于等效平衡,二者反应方向相反,二者的转化率之和为100%,丙的加入Y的量大于甲,向正方向进行的程度大;
B.甲丁属于等效平衡,二者的转化率之和为100%;
C.丙中可以看作先加入2molX和1molY,平衡后又加了1molY;
D.丙的物质的量是乙的2倍,物质的量增大,压强增大;甲乙相比,甲中增大了X的物质的量.
解答 解:A.甲丁属于等效平衡,二者反应方向相反,二者的转化率之和为100%,则甲丁热量之和为Q,丙的加入Y的量大于甲,向正方向进行的程度大,所以丙放出的热量大于甲,则丙丁热量之和大于Q,即c+d>Q,故A错误;
B.把丁中的物质完全转化为反应物,其物质的量与甲相同,则甲丁属于等效平衡,二者的转化率之和为100%,故B正确;
C.丙中可以看作先加入2molX和1molY,平衡后又加了1molY,增大反应物的浓度平衡正向移动,所以生成物的浓度增大,即丙中Z的物质的量浓度最大,故C正确;
D.丙的物质的量是乙的2倍,物质的量增大,压强增大,转化率减小,则转化率乙>丙;甲乙相比,甲中增大了X的物质的量,则X的转化率减小,则转化率甲>乙,所以X的转化率为:甲>乙>丙,故D错误.
故选BC.
点评 本题考查了等效平衡的建立判断、反应热的确定,解题的关键是相同条件下三容器中达到相同平衡状态的判断,题目难度中等.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
3.已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Cl-、Br-、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生.
根据上述实验判断,下列结论正确的是( )
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生.
根据上述实验判断,下列结论正确的是( )
| A. | 溶液中一定含有Br-、SO${\;}_{4}^{2-}$ | |
| B. | 溶液一定含有Na+,不含Ba2+ | |
| C. | 实验①与上述离子的检验没有关系,可以省略 | |
| D. | 由实验④可以判断溶液中含有Cl- |
4.能在水溶液中大量共存的一组离子是( )
| A. | H+、Fe3+、I-、SO${\;}_{4}^{2-}$ | B. | Al3+、Mg2+、CO${\;}_{3}^{2-}$、Cl- | ||
| C. | K+、Fe2+、Ca2+、NO3- | D. | HCO3-、Na+、OH-、MnO4- |
1.当光束通过下列物质的时候,能观察到丁达尔效应的是( )
| A. | 豆浆 | B. | 硫酸铜溶液 | C. | 蒸馏水 | D. | 食盐水 |
8.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 8g甲烷所含原子个数为2NA | |
| B. | 含2NA个氯气分子的氯气的质量为71g | |
| C. | 2L 0.5mol/L Al2(SO4)3溶液中含SO42-为NA | |
| D. | 标准状况下,以任意比例混合的甲烷和氢气的混合气22.4L所含的分子数为NA |
5.某短周期元素最低负价为-2价,该元素的离子跟其核外电子排布相同的离子形成的化合物是( )
| A. | K2S | B. | MgO | C. | MgS | D. | H2O2 |
2.从平时学生实验中我们发现,同学们在进行实验时出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作.请找出下列图示中正确的实验操作( )
| A. | 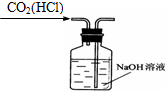 除去CO2中的HCl | B. | 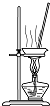 蒸发氯化钠溶液 | ||
| C. |  稀释浓硫酸 | D. | 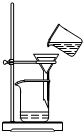 过滤 |
8.一定条件下,下列能与CH3CH2COOH发生反应的物质是( )
①紫色石蕊溶液 ②乙醇 ③苯 ④金属钠 ⑤氧化铜 ⑥碳酸钙 ⑦氢氧化镁 ⑧乙烷.
①紫色石蕊溶液 ②乙醇 ③苯 ④金属钠 ⑤氧化铜 ⑥碳酸钙 ⑦氢氧化镁 ⑧乙烷.
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤ | C. | ①②④⑤⑥⑦ | D. | 全部 |