题目内容
一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ、Ⅱ中正反应速率相同 |
| D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1 |
A
试题分析:A.根据题意可知:密闭容器Ⅰ、Ⅱ是在正逆两个相反的方向开始的反应,由于正反应是放热反应,所以逆反应就是吸热反应,所以因为装置与外界绝热,所以根据平衡移动原理:升高温度,平衡向吸热反应方向移动,因此容器Ⅰ的平衡转化率比容器Ⅱ小,所以容器Ⅰ中CO 的物质的量比容器Ⅱ中的多,正确;B.容器Ⅰ、Ⅲ中反应由于温度不同,所以反应的平衡常数不相同,错误;C.由于容器Ⅰ反应发生后温度升高,而Ⅱ中反应发生后温度降低,所以温度不同,它们的化学反应的正反应速率不相同,错误;D.若反应是在相同温度下进行,容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,但是反应是在绝热下进行,所以二者的CO2的转化率之和小于1,错误。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
 K(g)+NaCl(l)
K(g)+NaCl(l) 

 Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2 mCeO2+xH2+xCO
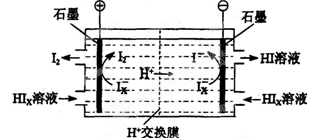
mCeO2+xH2+xCO HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。

 H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示: