题目内容
【题目】I.若已知: Cu(OH)2 (s) ![]() Cu2+ (aq)+2OH—(aq) △H= akJ/mol
Cu2+ (aq)+2OH—(aq) △H= akJ/mol
H2O(l) ![]() H+(aq) + OH—(aq) △H= bkJ/mol
H+(aq) + OH—(aq) △H= bkJ/mol
请写出Cu2+发生水解反应的热化学方程式________________________________,该反应的平衡常数为_______,已知:25℃时, Ksp[Cu(OH)2]=2.0×10-20 mol3/L3
II.室温下,现有①0. 2 mol/L NaOH溶液、②0.2 mol/L HX溶液,两溶液等体积混合后,测得溶液pH=8则:
(1)上述混合液中各离子浓度由大到小的顺序为_______________________
(2)pH=12的NaOH溶液与pH=2的HX等体积混合,混合后溶液显______性(填“酸”、“碱”或“中”)。
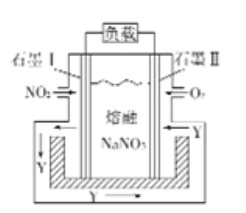
III. NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图。
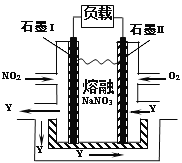
该电池在使用过程中正极反应为:O2+4e-+2N2O5=4NO3—,石墨I电极上生成氧化物Y,其电极反应为:______________________________。
【答案】 ![]() 5×10-9 c(Na+)>c(X-)>c(OH-)>c(H+) 酸 4NO2+4NO3--4e-=4N2O5
5×10-9 c(Na+)>c(X-)>c(OH-)>c(H+) 酸 4NO2+4NO3--4e-=4N2O5
【解析】I.Cu(OH)2(s)Cu2-(aq)+2OH-(aq)△H=akJ/mol;②H2O(1)H-(aq)+OH-(aq)△H=bkJ/mol,利用盖斯定律②×2-①得,Cu2-(aq)+2H2O(1)Cu(OH)2(s)+2H-(aq)△H=+(2b-a)kJ/mol;则平衡常数为:K=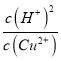 =
=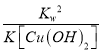 =
=![]() =5×10-9;故答案为:Cu2-(aq)+2H2O(1)Cu(OH)2(s)+2H-(aq)△H=+(2b-a)kJ/mol;5×10-9;
=5×10-9;故答案为:Cu2-(aq)+2H2O(1)Cu(OH)2(s)+2H-(aq)△H=+(2b-a)kJ/mol;5×10-9;
II.由题意知,c(Na+)>c(X-),根据溶液中电荷守恒得,c(H+)<c(OH- );酸碱的物质的量相等,且都是一元的,如果酸是强酸,混合液氢离子浓度和氢氧根浓度应相等,但实际上混合液呈碱性,所以酸是弱酸.
(1)0.2mol/LNaOH溶液和0.2mol/LHX溶液等体积混合后,得到的是NaX溶液,测得溶液pH=8,说明HX为弱酸,离子浓度顺序是:c(Na+)>c(X-)>c(OH- )>c(H+),故答案为:c(Na+)>c(X-)>c(OH- )>c(H+);
(2)pH=12的NaOH溶液与pH=2的HX等体积混合,HX是弱酸,则酸会剩余,得到的是HX和NaX的混合物,混合后溶液显酸性,故答案为:酸;
III. 根据图示,该电池在使用过程中的总反应为4NO2+O2=2N2O5,正极反应为:O2+4e-+2N2O5=4NO3—,则石墨I的电极反应为4NO2+4NO3--4e-=4N2O5,故答案为:4NO2+4NO3--4e-=4N2O5。