题目内容
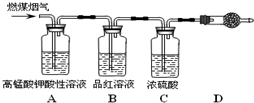
用如下装置可以完成一系列实验(图中夹持装置已略去).
请回答下列问题:
Ⅰ.若装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
II.若装置A中选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.请回答下列问题:
(1)写出用浓硫酸和浓盐酸混合制取HCl气体时,有利于HCl气体逸出的原因(写出两点)
(2)反应开始后,观察到②处棉花变成棕黄色,则①处包有的某固体物质可能是
a.MnO2 b.KCl c.KMnO4 d.Cu
写出②处发生反应的离子方程式
(3)在实验过程中,在③处能观察到
(4)反应较长时间后,②处的棕黄色褪去,产物之一为HIO3(强酸),写出该反应的离子方程式:

请回答下列问题:
Ⅰ.若装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 |
(1)写出用浓硫酸和浓盐酸混合制取HCl气体时,有利于HCl气体逸出的原因(写出两点)
浓硫酸具有吸水性
浓硫酸具有吸水性
,稀释时放热
稀释时放热
.(2)反应开始后,观察到②处棉花变成棕黄色,则①处包有的某固体物质可能是
C
C
.a.MnO2 b.KCl c.KMnO4 d.Cu
写出②处发生反应的离子方程式
Cl2+2I-=I2+2Cl-
Cl2+2I-=I2+2Cl-
.(3)在实验过程中,在③处能观察到
先变红后褪色
先变红后褪色
.(4)反应较长时间后,②处的棕黄色褪去,产物之一为HIO3(强酸),写出该反应的离子方程式:
5Cl2+I2+6H2O=2IO3-+10Cl-+12H+
5Cl2+I2+6H2O=2IO3-+10Cl-+12H+
.分析:Ⅰ.①二氧化硫能和水反应生成亚硫酸,石蕊试液遇酸变红色;②二氧化硫有漂白性能使品红溶液褪色;③二氧化硫有还原性,能和碘发生氧化还原反应.
Ⅱ、(1)根据浓硫酸的性质分析,浓硫酸有吸水性,稀释会放热;
(2)②处棉花变成棕黄色说明发生了化学反应,根据反应条件判断;
氯气有强氧化性,能和碘离子发生置换反应.
(3)氯气和水反应生成盐酸和次氯酸,次氯酸有漂白性;
(4)氯气和碘水能发生氧化还原反应结合题意写出离子方程式.
Ⅱ、(1)根据浓硫酸的性质分析,浓硫酸有吸水性,稀释会放热;
(2)②处棉花变成棕黄色说明发生了化学反应,根据反应条件判断;
氯气有强氧化性,能和碘离子发生置换反应.
(3)氯气和水反应生成盐酸和次氯酸,次氯酸有漂白性;
(4)氯气和碘水能发生氧化还原反应结合题意写出离子方程式.
解答:解:Ⅰ.①二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以显酸性,石蕊试液遇酸显红色.
②二氧化硫有漂白性,能使品红溶液褪色.
③二氧化硫有还原性,碘单质有氧化性,二氧化硫和碘能发生氧化还原反应,所以淀粉和碘水混合液会褪色.
故答案为:变红;褪色;还原性.
II.(1)浓硫酸有吸水性,吸收浓盐酸中的水分而促进浓盐酸的挥发;浓硫酸稀释时放出热量,也促进浓盐酸的挥发.
故答案为:浓硫酸具有吸水性,稀释时放热.
(2)反应开始后,观察到②处棉花变成棕黄色,说明有碘单质生成,所以①有氯气生成.
a.MnO2和浓盐酸反应必须在加热条件下才能反应,故错误.
b.KCl和氯化氢不反应,故错误.
c.KMnO4 有强氧化性,氯化氢有还原性,所以氯化氢和高锰酸钾能发生氧化还原反应生成氯气,氯气置换碘单质,故正确.
d.Cu和氯化氢不反应,故错误.
故选C.
氯气有强氧化性,能和碘离子发生置换反应生成碘单质,离子反应方程式为:Cl2+2I-=I2+2Cl-.
故答案为:C;Cl2+2I-=I2+2Cl-.
(3)氯气和水反应生成盐酸和次氯酸,石蕊试液遇酸变红色,次氯酸有漂白性,所以氯气通过蘸有石蕊溶液先变红后褪色.
故答案为:先变红后褪色.
(4)氯气有强氧化性,碘既有氧化性又有还原性,所以氯气和碘反应时,碘作还原剂,结合题意知,碘和氯气、水反应生成盐酸和碘酸,离子方程式为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
故答案为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
②二氧化硫有漂白性,能使品红溶液褪色.
③二氧化硫有还原性,碘单质有氧化性,二氧化硫和碘能发生氧化还原反应,所以淀粉和碘水混合液会褪色.
故答案为:变红;褪色;还原性.
II.(1)浓硫酸有吸水性,吸收浓盐酸中的水分而促进浓盐酸的挥发;浓硫酸稀释时放出热量,也促进浓盐酸的挥发.
故答案为:浓硫酸具有吸水性,稀释时放热.
(2)反应开始后,观察到②处棉花变成棕黄色,说明有碘单质生成,所以①有氯气生成.
a.MnO2和浓盐酸反应必须在加热条件下才能反应,故错误.
b.KCl和氯化氢不反应,故错误.
c.KMnO4 有强氧化性,氯化氢有还原性,所以氯化氢和高锰酸钾能发生氧化还原反应生成氯气,氯气置换碘单质,故正确.
d.Cu和氯化氢不反应,故错误.
故选C.
氯气有强氧化性,能和碘离子发生置换反应生成碘单质,离子反应方程式为:Cl2+2I-=I2+2Cl-.
故答案为:C;Cl2+2I-=I2+2Cl-.
(3)氯气和水反应生成盐酸和次氯酸,石蕊试液遇酸变红色,次氯酸有漂白性,所以氯气通过蘸有石蕊溶液先变红后褪色.
故答案为:先变红后褪色.
(4)氯气有强氧化性,碘既有氧化性又有还原性,所以氯气和碘反应时,碘作还原剂,结合题意知,碘和氯气、水反应生成盐酸和碘酸,离子方程式为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
故答案为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
点评:本题考查了二氧化硫和氯气的化学性质,难度不大,注意二氧化硫和次氯酸漂白性的区别.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目






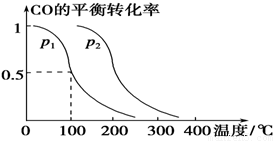
 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则: