题目内容
将3.48g四氧化三铁完全溶解在100mL 1mol·L-1 的硫酸中,然后加入K2Cr2O7溶液25mL,
恰好使溶液中的Fe2+全部转化为Fe2+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是 ( )
A.0.05mol·L—1 B.0.1mol·L—1 C.0.2mol·L—1 D.0.3mol·L—1
B
解析:
可以把Fe3O4看作FeO·Fe2O3,则n(Fe3O4)=n(FeO)=n(Fe2+),依次可知,在反应中Fe2+![]() Fe3+,Cr2O72-
Fe3+,Cr2O72-![]() 2Cr3+,若设K2Cr2O7溶液的物质的量浓度为c,则根据得失电子守恒有:
2Cr3+,若设K2Cr2O7溶液的物质的量浓度为c,则根据得失电子守恒有:![]() ,解得c=0.1mol·L-1。
,解得c=0.1mol·L-1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将3.48g四氧化三铁完全溶解在100mL 1mol·L-1硫酸中,然后加入K2Cr2O7溶液25 mL,恰好使溶液中Fe2+全部转化为Fe3+,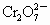 离子全部还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为
离子全部还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为
[ ]
|
A.0.05mol·L-1 |
B.0.1mol·L-1 |
|
C.0.2mol·L-1 |
D.0.3mol·L-1 |