��Ŀ����
��6�֣��ϳ�����ѹ�����º����10m3�״��ϳ������ڴ��������£����м״��ϳɣ���Ҫ��Ӧ�ǣ�2H2(g) + CO(g)  CH3OH(g) ��H =-181.6kJ��mol-1��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OH(g) ��H =-181.6kJ��mol-1��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
�űȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v�� v�����>������<������)��
��������ͬ�����CO��H2����T5�淴Ӧ��10 min��ﵽƽ�⣬��ʱc(H2)��0.4 mol��L��1�����ʱ���ڷ�Ӧ����v(CH3OH) �� mol��(L��min)��1��
�����������У��ϳ���Ҫ����ѭ������Ŀ���� ��
 CH3OH(g) ��H =-181.6kJ��mol-1��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OH(g) ��H =-181.6kJ��mol-1��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�| ���� | H2 | CO | CH3OH |
| Ũ��/��mol��L��1�� | 0.2 | 0.1 | 0.4 |
��������ͬ�����CO��H2����T5�淴Ӧ��10 min��ﵽƽ�⣬��ʱc(H2)��0.4 mol��L��1�����ʱ���ڷ�Ӧ����v(CH3OH) �� mol��(L��min)��1��
�����������У��ϳ���Ҫ����ѭ������Ŀ���� ��
�� > �� 0.03 mol��L��1��min��1 �� ���ԭ��CO��H2�������ʣ�����߲�����������ɣ���
��1���������ʵ�Ũ�ȿ�֪����ʱ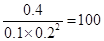 ��160�����Է�Ӧ������Ӧ������У�������Ӧ���ʴ����淴Ӧ���ʡ�
��160�����Է�Ӧ������Ӧ������У�������Ӧ���ʴ����淴Ӧ���ʡ�
��2�����ݣ�1����֪����ʼʱ������Ũ����1.0mol/L�������ڣ�2����������Ũ�ȱ仯����0.6mol/L�������ɼ״���0.3mol/L����״��ķ�Ӧ������0.3mol/L��10min��0.03 mol��L��1��min��1��
��3�����������У��ϳ�������ѭ�����������ԭ��CO��H2�������ʡ�
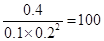 ��160�����Է�Ӧ������Ӧ������У�������Ӧ���ʴ����淴Ӧ���ʡ�
��160�����Է�Ӧ������Ӧ������У�������Ӧ���ʴ����淴Ӧ���ʡ���2�����ݣ�1����֪����ʼʱ������Ũ����1.0mol/L�������ڣ�2����������Ũ�ȱ仯����0.6mol/L�������ɼ״���0.3mol/L����״��ķ�Ӧ������0.3mol/L��10min��0.03 mol��L��1��min��1��
��3�����������У��ϳ�������ѭ�����������ԭ��CO��H2�������ʡ�

��ϰ��ϵ�д�
�����Ŀ
 cC(g)���÷�Ӧ�ﵽƽ����A�����Ũ��Ϊ0.5mol/L���ں����½��ܱ���������ԭ����2�����ٴδﵽƽ����A��Ũ��Ϊ0.3mol/L��������������ȷ����
cC(g)���÷�Ӧ�ﵽƽ����A�����Ũ��Ϊ0.5mol/L���ں����½��ܱ���������ԭ����2�����ٴδﵽƽ����A��Ũ��Ϊ0.3mol/L��������������ȷ���� 2NH3��g���ķ�Ӧ�Ⱥͻ�ѧƽ�ⳣ���ֱ�Ϊ��H��K, ����ͬ�¶�ʱ��Ӧ4NH3��g��
2NH3��g���ķ�Ӧ�Ⱥͻ�ѧƽ�ⳣ���ֱ�Ϊ��H��K, ����ͬ�¶�ʱ��Ӧ4NH3��g�� [Cu(NH3)3] Ac��CO������H��0��
[Cu(NH3)3] Ac��CO������H��0�� 2C��g����D��g������x��һ����Χ�ڱ仯ʱ��������ͨ�����ڷ�Ӧ�����¶ȣ�ʹ��Ӧ�ﵽƽ��ʱ�������������������ʵ���Ϊ5mol����ʹ��ʼ��Ӧ������Ӧ������У���x��ȡֵ��Χ�����ʺϵ��ǣ� ��
2C��g����D��g������x��һ����Χ�ڱ仯ʱ��������ͨ�����ڷ�Ӧ�����¶ȣ�ʹ��Ӧ�ﵽƽ��ʱ�������������������ʵ���Ϊ5mol����ʹ��ʼ��Ӧ������Ӧ������У���x��ȡֵ��Χ�����ʺϵ��ǣ� �� 2C��g������H<0������Ӧ�ﵽƽ��ı�һ��������x�����±�������y��һ��������ͼ�����ߵ���
2C��g������H<0������Ӧ�ﵽƽ��ı�һ��������x�����±�������y��һ��������ͼ�����ߵ���
 pC��g���ﵽƽ������¶Ȳ��䣬�����������С��ԭ����1/2�����ﵽ��ƽ��ʱ��C��Ũ��Ϊԭ����1��9��������˵������ȷ����
pC��g���ﵽƽ������¶Ȳ��䣬�����������С��ԭ����1/2�����ﵽ��ƽ��ʱ��C��Ũ��Ϊԭ����1��9��������˵������ȷ���� 2C������+��X D��������5min�ﵽƽ�⣬��ʱ����CΪ2mol���ⶨD��ƽ����Ӧ����Ϊ0.1mol/L?min������˵���д������ �� ��
2C������+��X D��������5min�ﵽƽ�⣬��ʱ����CΪ2mol���ⶨD��ƽ����Ӧ����Ϊ0.1mol/L?min������˵���д������ �� �� 2NH3��g������500��ʱ����2molN2��2molH2�����ݻ�Ϊ10L���ܱ������н��з�Ӧ���ﵽƽ��ʱ��NH3�����ܴﵽ��Ũ���ǣ� ��
2NH3��g������500��ʱ����2molN2��2molH2�����ݻ�Ϊ10L���ܱ������н��з�Ӧ���ﵽƽ��ʱ��NH3�����ܴﵽ��Ũ���ǣ� ��