题目内容
某温度下在容积为2L的密闭容器中,发生2X(g)+Y(g)?2W(g)的反应,当充入1mol X和1mol Y,经20s达到平衡时生成了0.4mol W.下列说法正确的是( )
分析:A、升高温度化学平衡向着吸热方向进行;
B、根据公式v=
计算化学反应速率;
C、增加X的量,则X的转化率会减小;
D、增大压强,正逆反应速率都加快.
B、根据公式v=
| △c |
| △t |
C、增加X的量,则X的转化率会减小;
D、增大压强,正逆反应速率都加快.
解答:解:A、升高温度化学平衡向着吸热方向进行,W的体积分数减小,反应逆向进行,所以逆反应方向是吸热的,该反应是放热反应,故A正确;
B、W的浓度变化表示的反应速率v=
=
=0.01mol/(L?s),所以用Y表示的反应速率0.005 mol/(L?s),故B错误;
C、增加X的量,则X的转化率会减小,Y的转化率增大,故C错误;
D、增大压强,正逆反应速率都加快,平衡向气体系数和减小的方向进行,即向着正反应方向移动,故D错误.
故选:A.
B、W的浓度变化表示的反应速率v=
| △c |
| △t |
| ||
| 20s |
C、增加X的量,则X的转化率会减小,Y的转化率增大,故C错误;
D、增大压强,正逆反应速率都加快,平衡向气体系数和减小的方向进行,即向着正反应方向移动,故D错误.
故选:A.
点评:本题考查学生影响化学平衡移动、化学反应速率以及化学反应速率的计算等知识,根据所学知识来回答即可,难度不大.

练习册系列答案
相关题目
某温度下,在容积为2L的密闭容器中加入物质A(g),发生反应:xA(g)?B(g)+C(g)△H>0
在不同时间,测得容器中各物质的物质的量如表所示:
下列说法正确的是( )
在不同时间,测得容器中各物质的物质的量如表所示:
| 0s | 20s | 40s | 60s | |
| n(A)/mol | a | 3.0 | 2.0 | 2.0 |
| n(B)/mol | 0 | 1.0 | 2.0 | c |
| n(C)/mol | 0 | 1.0 | b | 2.0 |
| A、反应在前20s内的平均速率为v(A)=0.05 mol?L-1?s-1 |
| B、40s时,反应的正反应速率和逆反应速率相等 |
| C、该温度下,反应的化学平衡常数为1 |
| D、若升高温度,则化学平衡常数减小 |
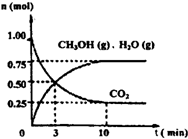 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.