��Ŀ����
ij�¶��£����ݻ�Ϊ2L���ܱ������м�������A��g����������Ӧ��xA��g��?B��g��+C��g����H��0
�ڲ�ͬʱ�䣬��������и����ʵ����ʵ��������ʾ��
����˵����ȷ���ǣ�������
�ڲ�ͬʱ�䣬��������и����ʵ����ʵ��������ʾ��
| 0s | 20s | 40s | 60s | |
| n��A��/mol | a | 3.0 | 2.0 | 2.0 |
| n��B��/mol | 0 | 1.0 | 2.0 | c |
| n��C��/mol | 0 | 1.0 | b | 2.0 |
| A����Ӧ��ǰ20s�ڵ�ƽ������Ϊv��A��=0.05 mol?L-1?s-1 |
| B��40sʱ����Ӧ������Ӧ���ʺ��淴Ӧ������� |
| C�����¶��£���Ӧ�Ļ�ѧƽ�ⳣ��Ϊ1 |
| D���������¶ȣ���ѧƽ�ⳣ����С |
������ͼ�����ݷ����жϣ�
xA��g��?B��g��+C��g��
��ʼ����mol�� a 0 0
�仯����mol�� 2x 2.0 2.0
ƽ������mol�� 2.0 2.0 2.0
xA��g��?B��g��+C��g��
��ʼ����mol�� a 0 0
�仯����mol�� x 1.0 1.0
20s����mol�� 3.0 1.0 1.0
2x+2.0=x+3.0
x=1.0mol
a=4mol
A�����ݻ�ѧ��Ӧ���ʸ���������������
B��40sʱ��A�����ʵ�����60��Cʱ���ʵ�����ͬ����Ӧ�ﵽƽ�⣬��Ӧ������Ӧ���ʺ��淴Ӧ������ȣ�
C�����ݻ�ѧƽ������ʽ����ƽ��Ũ�ȣ����ƽ�ⳣ��������������
D����Ӧ�����ȷ�Ӧ������ƽ��������У�ƽ�ⳣ������
xA��g��?B��g��+C��g��
��ʼ����mol�� a 0 0
�仯����mol�� 2x 2.0 2.0
ƽ������mol�� 2.0 2.0 2.0
xA��g��?B��g��+C��g��
��ʼ����mol�� a 0 0
�仯����mol�� x 1.0 1.0
20s����mol�� 3.0 1.0 1.0
2x+2.0=x+3.0
x=1.0mol
a=4mol
A�����ݻ�ѧ��Ӧ���ʸ���������������
B��40sʱ��A�����ʵ�����60��Cʱ���ʵ�����ͬ����Ӧ�ﵽƽ�⣬��Ӧ������Ӧ���ʺ��淴Ӧ������ȣ�
C�����ݻ�ѧƽ������ʽ����ƽ��Ũ�ȣ����ƽ�ⳣ��������������
D����Ӧ�����ȷ�Ӧ������ƽ��������У�ƽ�ⳣ������
����⣺ͼ�����ݷ����жϣ�
xA��g��?B��g��+C��g��
��ʼ����mol�� a 0 0
�仯����mol�� 2x 2.0 2.0
ƽ������mol�� 2.0 2.0 2.0
xA��g��?B��g��+C��g��
��ʼ����mol�� a 0 0
�仯����mol�� x 1.0 1.0
20s����mol�� 3.0 1.0 1.0
2x+2.0=x+3.0
x=1.0mol
a=4mol
A����Ӧ��ǰ20s�ڵ�ƽ������Ϊv��A��=
=0.025 mol?L-1?s-1����A����
B��40sʱ��A�����ʵ�����60��Cʱ���ʵ�����ͬ����Ӧ�ﵽƽ�⣬��Ӧ������Ӧ���ʺ��淴Ӧ������ȣ���B��ȷ��
C����ƽ��Ũ�ȿ�֪��ƽ�ⳣ��K=
=2����C����
D����Ӧ�����ȷ�Ӧ������ƽ��������У�ƽ�ⳣ������D����
��ѡB��
xA��g��?B��g��+C��g��
��ʼ����mol�� a 0 0
�仯����mol�� 2x 2.0 2.0
ƽ������mol�� 2.0 2.0 2.0
xA��g��?B��g��+C��g��
��ʼ����mol�� a 0 0
�仯����mol�� x 1.0 1.0
20s����mol�� 3.0 1.0 1.0
2x+2.0=x+3.0
x=1.0mol
a=4mol
A����Ӧ��ǰ20s�ڵ�ƽ������Ϊv��A��=
| ||
| 20s |
B��40sʱ��A�����ʵ�����60��Cʱ���ʵ�����ͬ����Ӧ�ﵽƽ�⣬��Ӧ������Ӧ���ʺ��淴Ӧ������ȣ���B��ȷ��
C����ƽ��Ũ�ȿ�֪��ƽ�ⳣ��K=
| ||||
|
D����Ӧ�����ȷ�Ӧ������ƽ��������У�ƽ�ⳣ������D����
��ѡB��
���������⿼���˻�ѧƽ��Ӱ�����ط�����ƽ�ⳣ������Ӧ�ã�����ʽ����Ӧ���ǽ���ؼ�����Ŀ�ѶȽϴ�

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
 2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
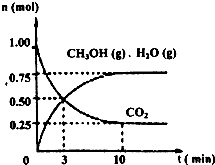
2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о��� ��ͼ����a��ͨ�����
��ͼ����a��ͨ�����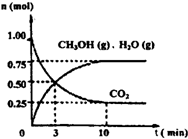 ��2012?������ģ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
��2012?������ģ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���