��Ŀ����
����Ŀ�����������(Na2S2O3)���н�ǿ�Ļ�ԭ�ԣ���������ǿ�ᷴӦ���ھ�ϸ��������Ӧ�ù㷺����SO2ͨ�밴һ���������Ƴɵ�Na2S��Na2CO3�Ļ����Һ�У����Ƶ�Na2S2O35H2O(���մ�)��
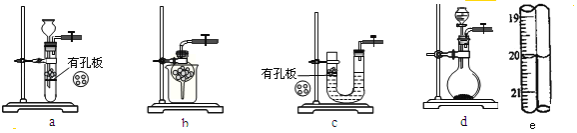
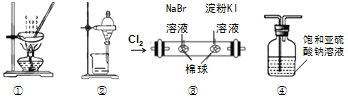
(1)ʵ������Na2SO3�������Ʊ�SO2����ѡ�õ����巢��װ����_____(ѡ����)������װ�������ԵIJ����ǣ��ر�ֹˮ�У���_______________��
(2)��Na2S��Na2CO3�Ļ����Һ�в���ͨ��SO2����Ĺ����У����֣�
��dz��ɫ�����������࣬��Ӧ�Ļ�ѧ����ʽΪ________________(���ɵ���Ϊ����)��
��dz��ɫ��������һ��ʱ�䲻�䣬����ɫ����������������Ӧ�Ļ�ѧ����ʽΪ__________________(���ɵ���Ϊ����)��
��dz��ɫ��������(��ʱ��Na2S2O3����)��
�ܼ���ͨ��SO2��dz��ɫ�����ֻ������࣬��Ӧ�Ļ�ѧ����ʽΪ_______________(���ɵ���Ϊ��ʽ��)��
(3)�Ʊ�Na2S2O3ʱ��Ϊ��ʹ��Ӧ�����������Na2S��Na2CO3�����ʵ���֮��ӦΪ_________��ͨ����Ӧ˳�ɱȽϳ����¶���ͬʱ��ͬ���ʵ���Ũ�ȵ�Na2S��Һ��Na2CO3��ҺpH�������_________��
(4)��������ƵĴ��ȿ��õζ������вⶨ��ԭ���ǣ�2S2O32��+I3��=S4O62��+3I����
��Ϊ��֤�����ʣ����������������Һ��������в���ȴ������ˮ����������___________��
��ȡ2.500g�����ʵ�Na2S2O35H2O�������50mL��Һ��ÿ��ȡ10.00mL��0.0500mol/L KI3��Һ�ζ�(�Ե���Ϊָʾ��)��ʵ����������(��3�γ�����Ϊ0.00���յ������ͼe�����ʲ��μӷ�Ӧ)��
��� | 1 | 2 | 3 |
����KI3��Һ�����/mL | 19.98 | 20.02 |
����ζ��յ��������_______________��Na2S2O35H2O(ʽ��248)������������(����4λС��)__________��
���𰸡�d ��Һ©��������ˮ����ˮ������˵������������ 3SO2+2Na2S=3S��+2Na2SO3 SO2+Na2CO3=Na2SO3+CO2 Na2S2O3+SO2+H2O=S��+2NaHSO3 2��1 ǰ�� ��ֹNa2S2O3��������O2���� ��Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ȥ 99.20%
��������
(1)��ΪNa2SO3������ˮ��a��b��cװ�þ�����ѡ�ã�ʵ������Na2SO3�������Ʊ�SO2����ѡ�õ����巢��װ����d���ر�ֹˮ�У��������Ժܺã����Һ©����ˮ���ܵ�����ƿ�У�
(2)���䷴Ӧԭ��ΪSO2+Na2S+H2O=H2S+Na2SO3��2H2S+SO2=3S��+2H2O������3SO2+2Na2S=3S��+2Na2SO3��
����ɫ��ζ������ΪCO2���壬�仯ѧ����ʽΪSO2+Na2CO3=Na2SO3+CO2��
�ۻ�ɫ�������ٵ�ԭ��ΪNa2SO3+S=Na2S2O3��
�ܸ�������Na2S2O3������ǿ�ᷴӦ������dz��ɫ�����������ԭ��ΪNa2S2O3+SO2+H2O=S��+2NaHSO3��
(3)3SO2+2Na2S=3S��+2Na2SO3�٣�SO2+Na2CO3=Na2SO3+CO2�ڣ�Na2SO3+S=Na2S2O3�ۣ����+��+����3��4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2������Na2S��Na2CO3�����ʵ���֮��Ϊ2��1����ΪSO2�Ⱥ�Na2S��Ӧ�������¶���ͬʱ��ͬ���ʵ���Ũ�ȵ�Na2S��Һ��Na2CO3��Һ��Na2S��Һ��pH����
(4)��������в���ȴ������ˮ��Ϊ�˸ϳ�ˮ�е�����������������Ʊ�������
�ڴﵽ�ζ��յ�ʱ��ɫͻ����30s����ɫ���ȸ��ݵζ����ĵı�Һ����������ƽ�����������2S2O32-+I3-=S4O62-+3I-�Ķ�����ϵ���㡣
(1)��ΪNa2SO3������ˮ��a��b��cװ�þ�����ѡ�ã�ʵ������Na2SO3�������Ʊ�SO2����ѡ�õ����巢��װ����d������װ�������ԵIJ����ǣ��ر�ֹˮ�У��������Ժܺã����Һ©����ˮ���ܵ�����ƿ�У�
(2)��dz��ɫ�����������࣬�䷴Ӧԭ��ΪSO2+Na2S+H2O=H2S+Na2SO3��2H2S+SO2=3S��+2H2O������Ӧ�Ļ�ѧ����ʽΪ��3SO2+2Na2S=3S��+2Na2SO3��
��dz��ɫ��������һ��ʱ�䲻�䣬����ɫ����������������Ӧ�Ļ�ѧ����ʽΪ����ɫ��ζ������ΪCO2���壬�仯ѧ����ʽΪSO2+Na2CO3=Na2SO3+CO2��
��dz��ɫ�������٣���ʱ��Na2S2O3���ɻ�ɫ���������ٵ�ԭ��Ϊ��Na2SO3+S=Na2S2O3��
�ܸ�������Na2S2O3������ǿ�ᷴӦ������ͨ��SO2��dz��ɫ�����ֻ������࣬����dz��ɫ�����������ԭ��Ϊ��Na2S2O3+SO2+H2O=S��+2NaHSO3��
(3)3SO2+2Na2S=3S��+2Na2SO3��
SO2+Na2CO3=Na2SO3+CO2��
Na2SO3+S=Na2S2O3��
��+��+����3��4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2������Na2S��Na2CO3�����ʵ���֮��Ϊ2��1����ΪSO2�Ⱥ�Na2S��Ӧ�������¶���ͬʱ��ͬ���ʵ���Ũ�ȵ�Na2S��Һ��Na2CO3��Һ��Na2S��Һ��pH����
(4)��Ϊ��֤�����ʣ����������������Һ��������в���ȴ������ˮ���������ǣ���ֹNa2S2O3��������O2������
�ڴﵽ�ζ��յ�ʱ�����μ����һ�������������Һ����Һ��ɫ��ȥ�Ұ�����ڲ��仯��2�����ĵ�I2��Һ�����ƽ��ֵΪ20.00mL��
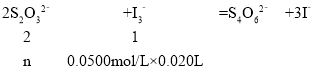
![]() �����n=0.002mol��250ml��Һ�к���Cr2O72�����ʵ���Ϊ0.002mol��
�����n=0.002mol��250ml��Һ�к���Cr2O72�����ʵ���Ϊ0.002mol��![]() =0.01mol��Na2S2O35H2O(ʽ��248)������������=
=0.01mol��Na2S2O35H2O(ʽ��248)������������=![]() ��100%=99.20%��
��100%=99.20%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�