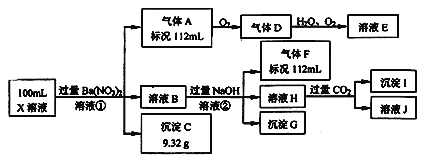
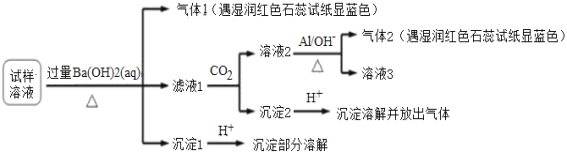
题目内容
【题目】氮是与人类生活密切相关的一种重要元素。根据要求回答:
(1)写出N2的电子式_________;将空气中的氮气转化为含氮化合物的过程称为固氮,当今大规模人工固氮的主要方法是(用化学方程式表示)______________________________。
(2)某无色混合气体中可能含有NH3、O2、H2、NO、HCl等气体,将它通过浓H2SO4 后发现气体体积减少,将剩余气体与空气接触后呈红棕色,此混合气中一定不含有_________。
(3)实验室有多种制取氨气的方法,其中加热消石灰与氯化铵的混合固体就是方法之一。
①写出此反应的化学方程式:_____________________________________________。
②氨气可使湿润的红色石蕊试纸变蓝的原因(用相应的方程式说明)_______________。
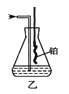
③用乙装置(见图)吸收一段时间氨气后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,锥形瓶中不可能生成的物质是___(选填序号)。
a H2 b NO2 c HNO3 d NH4NO3
写出乙装置中氨催化氧化的化学方程式:__________________________。
(4)已知3Cl2+2NH3==N2 + 6HCl,若NH3过量则还有反应:NH3+ HCl== NH4Cl 。常温常压下,若在一密闭容器中将15mLCl2和40mL NH3充分混合反应后,剩余气体的体积为____mL。
【答案】![]() N2+3H2
N2+3H2 ![]() 2NH3 O2、HCl 2NH4Cl+Ca(OH)2
2NH3 O2、HCl 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O NH3+H2ONH3H2O、NH3H2ONH4++OH- a 4NH3+5O2
CaCl2+2NH3↑+H2O NH3+H2ONH3H2O、NH3H2ONH4++OH- a 4NH3+5O2![]() 4NO+6H2O; 5
4NO+6H2O; 5
【解析】
(1)氮气中有三个共价键,即氮原子间形成三对共用电子对;规模人工固氮主要是利用氮气与氢气在一定条件下反应生成氨气的过程;
(2)与浓硫酸反应的气体是氨气,空气中呈红棕色的气体是一氧化氮,能够与氨气、一氧化氮反应的不能存在;
(3)①该反应为实验室制备氨气的常见反应;
②氨气溶于水生成一水合氨,一水合氨能够电离出氢氧根离子;
③氨气与氧气催化氧化生成一氧化氮和水,据此分析分析;
(4)根据反应3Cl2+2NH3→N2+6HCl判断氨气过量,计算出生成的氯化氢的体积,再根据氯化氢与氨气生成氯化铵,计算出二者恰好反应,最后剩余的气体是氮气;
(1)氮原子间形成三对共用电子对,电子式为![]() ,工业上常利用氮气与氢气高温高压催化剂条件下发生反应生成氨气来实现人工固氮,其化学方程式为:N2+3H2
,工业上常利用氮气与氢气高温高压催化剂条件下发生反应生成氨气来实现人工固氮,其化学方程式为:N2+3H2 ![]() 2NH3;
2NH3;
故答案为:![]() ;N2+3H2
;N2+3H2 ![]() 2NH3;
2NH3;
(2)将它通过浓H2SO4后发现气体体积减少,说明一定含有氨气,所以一定没有氯化氢;将剩余气体与空气接触后,气体呈红棕色,说明一定含有一氧化氮气体,所以一定没有氧气,
故答案为:O2、HCl;
(3)①消石灰为氢氧化钙,与氯化铵在加热条件下可制备氨气,其反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O,
CaCl2+2NH3↑+H2O,
故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O;
CaCl2+2NH3↑+H2O;
②湿润的红色的石蕊试纸变蓝的原因是氨气与水反应生成了一水合氨,一水合氨电离出氢氧根离子,反应的方程式为:NH3+H2ONH3H2O、NH3H2ONH4++OH-,
故答案为:NH3+H2ONH3H2O、NH3H2ONH4++OH-;
③氨气与氧气催化氧化生成了一氧化氮和水,一氧化氮能够与氧气生成二氧化氮,二氧化氮与水反应生成一氧化氮和硝酸,硝酸能够与氨气反应生成硝酸铵,所以不可能生成的是氢气,a项正确;氨气催化氧化方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
故答案为:a;4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(4)15mL Cl2和40mLNH3反应,根据反应方程式3Cl2+2NH3=N2+6HCl,15mL氯气反应消耗氨气10 mL,生成5 mL氮气和30 mL氯化氢;由于氨气与氯化氢反应生成氯化铵,剩余的氨气恰好与生成的氯化氢反应,最后剩余的气体是氮气,体积为5mL,
故答案为:5。

【题目】化学实验是学习理解化学知识的基础,它以其生动的魅力和丰富的内涵在化学学习中发挥着独特的功能和作用。请回答下列问题:
I .实验室欲用固体NaOH配制100 mL 1mol·L-1的NaOH溶液。
(1)配制上述溶液,下列不能用到的仪器是_______________(用序号回答)。
A.烧杯 B.大试管 C.玻璃棒 D.100 mL容量瓶
(2)除上述仪器外,还一定要的玻璃仪器有______________。
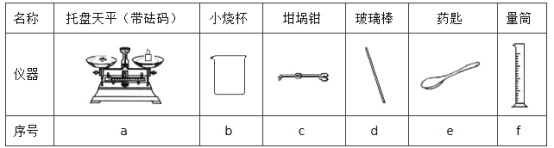
(3)用托盘天平称取NaOH固体的质量为_________g,从下表中选择称量NaOH固体所需要的仪器 __________________(填序号)。
(4)下列情况使所配得溶液的浓度如何变化?(填“偏高”“ 偏低”或“不变”)
A.未洗涤溶解氢氧化钠的烧杯_________。
B.容量瓶使用前用蒸馏水洗过,内壁附有水珠而未干燥处理___________。
C.定容时加水超过了刻度线,将多出的液体吸出___________。
II.已知化合物甲和乙都不溶于水,甲可溶于质最分数大于或等于98%的浓硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器,甲与硫酸不发生化学反应)。
请填写下列空白,完成由上述混合物得到固体甲的实验设计。
序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) | |
① | 溶解 | 将混合物放入烧杯中,加入98% H2SO4____。 | |
② | _____________ | ||
③ | 稀释(沉淀) | ____________ | |
④ | 过滤 | ||
⑤ | _________ | 向④的过滤器中注入少量蒸馏水,使水面浸过沉淀物,待水滤出后,再次加水洗涤,连洗几次。 | |
⑥ | 检验沉淀是否洗净 | ____________________。 | |