��Ŀ����
��Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ�Ϻϳɼ״��ķ�ӦΪ��CO(g)��2H2(g) CH3OH(g)����H
CH3OH(g)����H
��1����֪���÷�Ӧ��300�棬5MPa���������Է����У���H 0����S 0���������������
��2����300�棬5MPa�����£���0.20mol�� CO��0.58mol H2�Ļ���������2L�ܱ�����������Ӧ����Ӧ�����м״������ʵ���Ũ����ʱ��ı仯��ͼ��ʾ��
����0��2min�ڣ���H2��ʾ��ƽ����Ӧ����Ϊ mol��L-1��s-1 ��CO��ת����Ϊ ��
����ʽ����300��ʱ�÷�Ӧ��ƽ�ⳣ��K�� ��
��300��ʱ����0.50mol CO��1.00mol H2��1.00 mol CH3OH�����ݻ�Ϊ2L���ܱ������У���ʱ��Ӧ�� ��
A�����������ƶ� B�����淽���ƶ� C������ƽ��״̬ D�����ж�
�����д�ʩ�����Ӽ״����ʵ��� ��
A��ѹ��������� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���0.20mol CO��0.58mol H2
��3���������������䣬ʹ��Ӧ��500���½��У���ͼ�������״������ʵ���Ũ����ʱ��ı仯��ʾ��ͼ��
��1���� ������1�֣���2����0.02 20%����2�֣�
��K��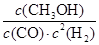 ��
��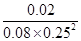 ��4��3�֣���B��2�֣� ��ABD��2�֣�
��4��3�֣���B��2�֣� ��ABD��2�֣�
��3��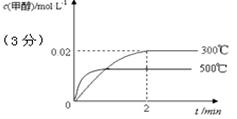 ��2�֣�
��2�֣�
���������������1�����ݡ�G����H��T����S��֪��ֻҪ��GС��0����Ӧ�����Է��ġ���ӦCO(g)��2H2(g) CH3OH(g)����ֵ��С�Ŀ��淴Ӧ�����Ը��ݸ÷�ӦCO(g)��2H2(g)
CH3OH(g)����ֵ��С�Ŀ��淴Ӧ�����Ը��ݸ÷�ӦCO(g)��2H2(g) CH3OH(g)��300�棬5MPa���������Է����п�֪���÷�Ӧ�Ħ�H��0����S��0��
CH3OH(g)��300�棬5MPa���������Է����п�֪���÷�Ӧ�Ħ�H��0����S��0��
��2���ٸ���ͼ���֪����Ӧ���е�2minʱ�ﵽƽ��״̬����ʱ�״���Ũ����0.02mol/L������ݷ���ʽ��֪����������Ũ����0.04mol/L��������0��2min�ڣ���H2��ʾ��ƽ����Ӧ����Ϊ0.04mol/L��2min��0.02mol/(L1min)������Ϊ����CO�����ʵ���Ũ����0.02mol/L����CO����ʼŨ�ȣ�0.2mol/L��2L��0.1mol/L������CO��ת���ʣ�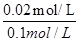 ��100%��20%��
��100%��20%��
�ڸ��ݢ��з�����֪��ƽ��ʱ������CO��Ũ�ȷֱ���0.58mol��2L��0.04mol/L��0.25mol/L��0.1mol/L��0.02mol/L��0.08mol/L�����״���ƽ��Ũ����0.02mol/L�����ڻ�ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը��¶��·�Ӧ��ƽ�ⳣ��K��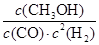 ��
��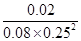 ��4��
��4��
��300��ʱ����0.50mol CO��1.00mol H2��1.00 mol CH3OH�����ݻ�Ϊ2L���ܱ������У���ʱŨ���̣�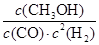 ��
��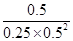 ��8��4�����Է�Ӧ���淴Ӧ�����ƶ�����ѡB��
��8��4�����Է�Ӧ���淴Ӧ�����ƶ�����ѡB��
�ܸ÷�Ӧ�������С�ķ��ȵĿ��淴Ӧ����A��ѹ���������ѹǿ����ƽ��������Ӧ�����ƶ����״��IJ�������A��ȷ��B����CH3OH(g)����ϵ�з��룬ƽ��������Ӧ�����ƶ����״���������B��ȷ��C������He��ʹ��ϵ��ѹǿ����ƽ�ⲻ�ƶ����״����ʲ��䣬C����ȷ��D���ٳ���0.20mol CO��0.58mol H2��ƽ��������Ӧ�����ƶ����״��IJ�������D��ȷ����ѡABD��
��3�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������������������䣬ʹ��Ӧ��500���½��У���Ӧ�������ﵽƽ���ʱ����٣���������ƽ��������Ӧ�����ƶ�����˼״���Ũ�Ƚ��ͣ����Լ״������ʵ���Ũ����ʱ��ı仯��ʾ��ͼΪ ��
��
���㣺���鷴Ӧ�Է���Ӧ�á�ת���ʡ�ƽ�ⳣ�����㡢���������ƽ��״̬��Ӱ���Լ�ͼ���������ͼ��

��¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ��H =" a" kJ mol��1
2Fe(s)+3CO2(g) ��H =" a" kJ mol��1
��1����֪�� ��Fe2O3(s)+3C(ʯī) = 2Fe(s)+3CO(g) ��H1 =" +" 489.0 kJ mol��1
��C(ʯī)+CO2(g) = 2CO(g) ��H2 =" +" 172.5 kJ mol��1
��a = kJ mol��1��
��2��ұ������Ӧ��ƽ�ⳣ������ʽK = ���¶����ߺ�Kֵ ������������䡱��С������
��3����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=64����2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
| | Fe2O3 | CO | Fe | CO2 |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
�� ��������CO��ƽ��ת����Ϊ ��
�� ����˵����ȷ���� ������ĸ����
a���������������ܶȺ㶨ʱ����־��Ӧ�ﵽƽ��״̬
b����������CO��ƽ��ת���ʴ����ҵ�
c���ס��������У�CO��ƽ��Ũ��֮��Ϊ2��3
d������Fe2O3�������CO��ת����
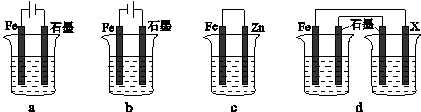
��4����ȡһ����ʩ�ɷ�ֹ������ʴ������װ���е��ձ����ʢ�е�Ũ�ȡ��������NaCl��Һ��
����a-cװ���У��ܱ��������� ������ĸ����
������dװ�ñ�������X���ĵ缫����Ӧ�� �������ƣ���
��16�֣���ҵ�Ͽ����ں����ܱ������в������з�Ӧ�Ʊ��״���
CO��g����2H2��g�� CH3OH��g��
CH3OH��g��
��1���������������Ϊ�жϷ�Ӧ�ﵽƽ��״̬�����ݵ��ǣ�����ţ� ��
A������CH3OH ������������H2������֮��Ϊ1�U2
B����������ƽ����Է����������ֲ���
C�����������ܶȱ��ֲ���
D����ϵ�ڵ�ѹǿ���ֲ���
��2���±���������Ϊ�÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����
| �¶�/�� | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
�ٷ�Ӧ��ƽ�ⳣ������ʽΪK= �����ϱ������жϣ��÷�Ӧ�ġ�H 0����������������������������¶ȣ�����Ӧ���� �����������С�����䡱����
��ij�¶��£���2molCO��6molH2����һ���ݻ�Ϊ2L���ܱ������У��ﵽƽ��ʱc(H2)=1.4mol/L����CO��ת����Ϊ ����ʱ���¶�Ϊ ��
��3�������CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��������ţ�
A������
B���������Ч�Ĵ���
C�����������³���CO
D�����������³���H��
E�����������³��뺤��
F����ʱ����CH3OH
��4��һ�������£�CO��H2�ڴ�������������1molCH3OH�������仯Ϊ90.8kJ�����¶��£��������ݻ���ͬ���ܱ������У�����ͬ��ʽͶ�ϣ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
| ���� | �� | �� | �� | |
| Ͷ�Ϸ�ʽ | 1molCO��2molH2 | 1molCH3OH | 2molCH3OH | |
| ƽ������ | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| ��ϵѹǿ(Pa) | p1 | p2 | p3 | |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ԭ��ת���� | ��1 | ��2 | ��3 | |
���з�����ȷ���� ��������ţ�
A��2c1��c3 B��2 p1��p3 C��|a|��|b|��90.8 D����1����3��1
I���跴Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g)��ƽ�ⳣ��ΪK1����Ӧ ��Fe(s)+H2O(g)
FeO(s)+CO(g)��ƽ�ⳣ��ΪK1����Ӧ ��Fe(s)+H2O(g)  FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
��1�����з�Ӧ��CO2(g)+H2(g)
 CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��
CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��A����С��Ӧ�����ݻ�
B������Ӧ�����ݻ�
C�������¶�
D�������¶�
E��ʹ�ú��ʵĴ���
F���跨����CO����
��2������ӦFe(s)+CO2(g)
 FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)
FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)  FeO(s)+H2(g)���¶�T2�½��У���֪T1��T2����c(CO2)��c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)��
FeO(s)+H2(g)���¶�T2�½��У���֪T1��T2����c(CO2)��c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)��A��ǰ�ߴ� B�����ߴ� C��һ���� D�����ж�
II����1�������ı��淢�������ڴ����dz��õķ�������������ƽ��Ҫ��Ӧ�ķ���ʽ��
��Na2FeO2+��NaNO2+��H2O=��NaFeO2+��NH3��+��NaOH
��2���������䡢ŨHNO3�����ۻ����ܴﵽ����Ŀ�ģ���ͬŨ�ȵ�HNO3������Ӧ�Ļ�ԭ����ܸ��ӣ���ֲ�������ͼ��

��ͼʾ��֪������HNO3������Ӧ�Ĺ����� ��
�ڹ�ҵ��һ�㲻����Ũ������������洦��������ܵ�ԭ���� ��
��3������(M)�ĸ�ʴ����Ϊ������Ӧ��M-ne-��Mn+�������������洦���ķ����⣬���з���Ҳ���������õ��� (����ĸ���)
A�������в�����Ƚ����Ƴɲ����
B��������Ʒ�����п
C��������к�̼�����Ƴ�����
D����ˮ����բ����ֱ����Դ�ĸ�������
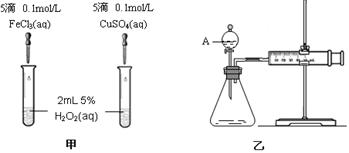
����ͭ�����仯�������ճ�������Ӧ�ù㷺��ij�о���ѧϰС���ô�ͭ��������Fe�������������Ӧ�ù���A����ϡ�����ܽ�A��Ȼ����Լ�������Һ��pH�����ҺB����ҺB��ϵ�в����ɵ��Ȼ�ͭ���壬��ش�
��1������A��ϡ�����ܽ��ԭ���� ��
��2��������ҺB���Ƿ����Fe3+�ķ����� ��
��3����֪Ԫ���ڸ�̬ʱ�����������ԣ���������CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ�����ȣ�����CuCl������������CuCl�����ӷ���ʽ�� ��
����1�� �����£�ijͬѧ��ϡ�����백ˮ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±���
| ʵ���� | ��ˮ���ʵ���Ũ�� (mol��L��1) | �������ʵ���Ũ�� (mol��L��1) | �����Һ pH |
| �� | 0.1 | 0.1 | pH=5 |
| �� | C | 0.2 | pH=7 |
| �� | 0.2 | 0.1 | pH��7 |
��ش�:�ӵڢ�������������������û����Һ����ˮ�������c(H+)�� mol��L��1���ӵڢ������������C 0.2 mol��L��1��ѡ�>������<�����������ӵڢ������������֪�������Һ��c(NH4+)
c(NH3��H2O)��ѡ�>������<����������
��2��д������������ҺNH4+����Ũ���ɴ�С��˳�� > > > ����ѡ���ţ���
A��0.1mol��L��1NH4Cl
B��0.1mol��L��1NH4Cl��0.1mol��L��1NH3��H2O
C��0.1mol��L��1NH3��H2O
D��0.1mol��L��1NH4Cl��0.1mol��L��1HCl

 p C��ij�¶��´ﵽƽ��
p C��ij�¶��´ﵽƽ�� 2SO3����д���пհף�
2SO3����д���пհף�