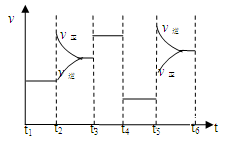题目内容
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
(1)现有反应③CO2(g)+H2(g)
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)
 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。请配平主要反应的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。

①图示可知,分析HNO3与铁反应的规律是 。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是 。
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬等金属制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
I.(1)吸热(2分)D、F(2分)
(2)A(2分)
Ⅱ.(1)6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3+7NaOH(2分)
(2)①硝酸的浓度越大,其还原产物中氮元素化合价越高(2分)
(其它合理答案均给分,如硝酸的浓度越大,气体生成物中二氧化氮的含量越高;或者,只有硝酸浓度较低时,产物中才会出现氮气;等等)
②硝酸易挥发,且不稳定,见光易分解,故不易操作(1分)生成物对环境污染严重(1分)
(3)A、B、D(2分)
(对一个或两个给1分,全对给2分,但只要出现C不给分)
解析试题分析:已知:①Fe(s)+CO2(g) FeO(s)+CO(g);②Fe(s)+H2O(g)
FeO(s)+CO(g);②Fe(s)+H2O(g) FeO(s)+H2(g);利用盖斯定律将①-②可得:③H2(g)+CO2(g)
FeO(s)+H2(g);利用盖斯定律将①-②可得:③H2(g)+CO2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
则K3=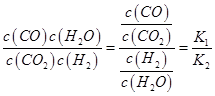 ,依据图表平衡常数数据分析,温度升高
,依据图表平衡常数数据分析,温度升高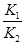 增大,说明平衡正向进行,反应是吸热反应;③H2(g)+CO2(g)
增大,说明平衡正向进行,反应是吸热反应;③H2(g)+CO2(g) CO(g)+H2O(g)反应是吸热反应,反应前后气体体积不变,要使反应在一定条件下建立的平衡向正反应方向移动,则
CO(g)+H2O(g)反应是吸热反应,反应前后气体体积不变,要使反应在一定条件下建立的平衡向正反应方向移动,则
A.缩小反应容器容积实质增大压强,反应前后气体体积不变,平衡不动;A不符合;
B.扩大反应容器容积,压强减小,反应前后气体体积不变,平衡不动;B不符合;
C.反应是吸热反应,降低温度,平衡向放热反应方向进行,平衡逆向进行,C不符合;
D.反应是吸热反应,升高温度,平衡向吸热反应方向进行,平衡正向进行,D符合;
E.使用合适的催化剂,催化剂只改变反应速率,不改变平衡,E不符合;
F.设法减少CO的浓度,减少生成物浓度平衡正向进行,F符合;
答案为:吸热反应;DF;
(2)反应速率随温度变化,温度越高,反应速率越大,所以反应速率①大,选A.
Ⅱ、(1)Na2FeO2+NaNO2+H2O→NaFeO2+NH3↑+NaOH中,铁元素化合价从+2价变化为+3价,氮元素化合价从+3价变化为-3价,Na2FeO2~NaFeO2~e-,NaNO2~NH3~6e-,依据电子守恒Na2FeO2的配平系数为6,NaFeO2的配平系数为6,NaNO2和NH3的配平系数为1,依据原子守恒配平NaOH,配平系数为7,H2O的配平系数为5,化学方程式为:
6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3↑+7NaOH,
答案为:6Na2FeO2+NaNO2+5H2O=6NaFeO2+NH3↑+7NaOH;
(2)①硝酸的浓度越大,气体生成物中二氧化氮的含量越高,只在硝酸浓度较低时,产物中才会出现氮气,答案为:硝酸浓度越大,其还原产物中氮元素的价态越高;
②工业上一般不用冷浓硝酸进行铁表面处理,浓硝酸具有易挥发,见光分解,生成产物污染空气等性质,答案为:硝酸易挥发,不稳定,见光易分解,故不易操作,生成物对环境污染严重;
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,防止腐蚀是避免金属失电子腐蚀反应;
A.在铁中掺入铬等金属制成不锈钢,原因是用铬对钢进行合金化处理时,把表面氧化物的类型改变成了类似于纯铬金属上形成的表面氧化物.这种紧密粘附的富铬氧化物保护表面,防止进一步地氧化.这种氧化层极薄,透过它可以看到钢表面的自然光泽,使不锈钢具有独特的表面.而且,如果损坏了表层,所暴露出的钢表面会和大气反应进行自我修理,重新形成这种“钝化膜“,继续起保护作用,A符合;
B.在铁制品表面镀锌,锌比铁活泼做原电池负极,铁做正极被保护,B符合;
C.提高铁中含碳量,制成生铁,含碳越高,碳和铁在电解质溶液中越易形成原电池,铁做负极被腐蚀,C不符合;
D.将水库铁闸门与直流电源的负极相连,形成电解池,闸门做阴极被保护,D符合;
选ABD.
考点:化学平衡常数的含义;氧化还原反应方程式的配平;化学反应速率的影响因素;化学平衡的影响因素;金属防护的常用方法

在体积为2 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g) △H=Q,化学平衡常数K与温度T的关系如下表:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)Q____0(填 “>”、“<”),升高温度,化学平衡向________(填“正反应”或“逆反应”)方向移动。
(2)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温度为__________;在此温度下,若该容器中含有1mol CO2、3mol H2、2mol CO、2mol H2O,则此时反应所处的状态为____________(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”),此温度平衡时CO2的浓度为___________ mol·L-1;在此温度下,若该容器中含有1.5mol CO2、3.5mol H2、1.5mol CO、1.5mol H2O达到平衡时CO2的浓度为___________ mol·L-1。
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题: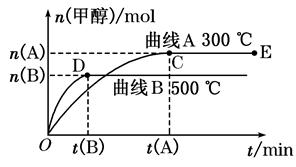
(1)反应达到平衡时,平衡常数表达式K=_________________,升高温度,K值___________(填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(选填选项字母)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
D.重新平衡时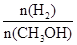 增大 增大 |
I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。
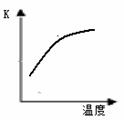
已知该反应的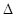 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO2)=_________mol/L min
min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
| A.减少Fe的量 | B.增加Fe2O3的量 |
| C.升高反应温度 | D.移出部分CO2 |
Ⅱ.已知化学反应①:Fe(s)+CO2(g)
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(4)通过表格中的数值可以推断:反应①的△H_ O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K3=____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K3=__________。据此关系式和上表数据,也能推断出反应③的△H_ _0(填“>”“<”)。
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
①下列时间段平均反应速率最大的是__________,最小的是______________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~30 h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为 。反应开始后的12小时内,在第___________种催化剂的作用下,收集的CH4最多。

 CH3OH(g);ΔH
CH3OH(g);ΔH
 4NH3 (g)+3O2 (g)+ Q
4NH3 (g)+3O2 (g)+ Q 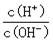
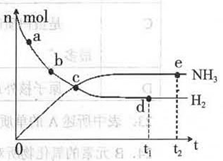
 2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。