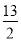题目内容
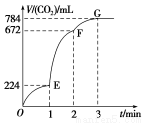
在298 K、1.01×105Pa下,将22 g CO2通入1 mol·L-1NaOH溶液750 mL中充分反应,
测得反应放出x kJ的热量。已知该条件下,1 mol CO2通入2 mol·L-1NaOH溶液1 L中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=(4x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1
CD
【解析】根据碳元素和钠元素守恒,第一种情况反应的方程式为2CO2+3NaOH=Na2
CO3+NaHCO3+H2O,可得热化学方程式①:2CO2(g)+3NaOH(aq)=Na2CO3(aq)+NaHCO3(aq)+H2O(l) ΔH=-4x kJ·mol-1;同理得第二种情况的热化学方程式②:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(1) ΔH=-y kJ·mol-1。利用盖斯定律,①-②得CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1。

练习册系列答案
相关题目