题目内容
下列有关化学反应速率的说法不正确的是( )
A.化学反应达到最大限度时,正逆反应速率也达到最大且相等
B.催化剂能降低化学反应的活化能,加快反应速率,提高生产效率
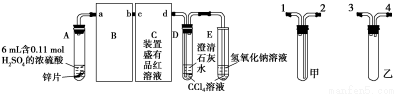
C.用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率
D.用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快
A
【解析】反应达到最大限度时,正逆反应速率相等但不是最大,A错误。催化剂虽然不影响平衡的移动,但缩短了达到平衡的时间,提高了生产效率,B正确。C项中能构成铜锌原电池,锌作负极,加快反应速率。D项中浓硫酸使铁钝化,不产生H2。

练习册系列答案
相关题目