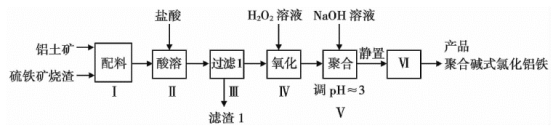
题目内容
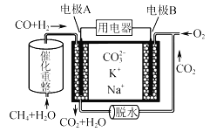
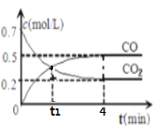
【题目】一定条件下铁可以和CO2发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
(1)t1时,正、逆反应速率的大小关系为ν正______ν逆(填“>”“<”或“=”);
(2)4分钟内,CO2的转化率为__________;CO的平均反应速率v(CO)=__________________;
(3)下列条件的改变能减慢其反应速率的是______________(选填序号)
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是__________________(选填序号)
①v(CO2)=v(CO)
②单位时间内生成n molCO2的同时生成n mol CO
③ 容器中气体压强不随时间而变化
④容器中气体的平均分子量不随时间而变化
【答案】 > 71.4% 0.125mol·L-1·min-1 ①③ ②④
【解析】
分析图像:CO2初始浓度为0.7mol/L,CO初始浓度为0,反应开始后CO2浓度逐渐减小,CO浓度逐渐增大,到第4min时都保持不变。开始正反应速率V正最大,逆反应速率V逆=0,第4min时V正=V逆,反应已达平衡状态。根据化学平衡状态的特征和影响化学反应速率的因素来作答。
(1)由题意可知初始只投入了反应物,从正反应开始直到第4min建立平衡状态,在此过程中正反应速率始终大于逆反应速率,最后正、逆反应速率相等。从图像上看,t1时的点处于建立平衡的过程中,所以V正>V逆;
(2)4mim内CO2的转化率=![]() =
=![]() 71.4%;
71.4%;
4min内CO浓度增加了0.5mol/L,CO的平均反应速率v(CO)=![]() ;
;
(3)根据影响反应速率的因素①降低温度,减慢反应速率,①符合题干要求;②因铁粉是固体,固体物质的浓度几乎不随取用量的改变而变化,所以减少铁粉的质量,浓度没有变化,反应速率不变,②不符合题干要求;③保持压强不变,充入He使容器的体积增大,CO和CO2的浓度将减小,反应速率减小,③符合题干要求;④保持体积不变,充入He使体系压强增大,CO和CO2的浓度没有变化,反应速率不变,④不符合题干要求。答案选①③;
(4)①v(CO2)=v(CO),不能确定正反应速率与逆反应速率的相对大小,所以不能确定反应是否达到平衡状态,①不符合题意;②单位时间内生成n molCO2表示逆反应速率v(CO2)逆,单位时间内生成n mol CO表示正反应速率v(CO)逆,“单位时间内生成n molCO2的同时生成n mol CO”,则v(CO2)逆:v(CO)逆=1:1,等于CO2、CO化学计量数之比,即正反应速率=逆反应速率,反应已达平衡状态,②符合题意;③在温度和容积一定时,压强与气体分子数成正比,由反应式Fe(s)+CO2(g)![]() FeO(s)+CO(g)可知,反应前后气体分子数不变,所以反应过程中气体压强一直没有变化,即压强不随时间而变化不能说明反应已达平衡状态,③项不符合题意;④气体平均相对分子质量=
FeO(s)+CO(g)可知,反应前后气体分子数不变,所以反应过程中气体压强一直没有变化,即压强不随时间而变化不能说明反应已达平衡状态,③项不符合题意;④气体平均相对分子质量=![]() ,尽管气体物质的量一直保持不变,但气体CO、CO2的质量一直在变化,所以气体平均相对分子质量一直在变化,所以容器中气体的平均相对分子质量不随时间而变化可以说明反应已达平衡状态,④项符合题意;答案②④。
,尽管气体物质的量一直保持不变,但气体CO、CO2的质量一直在变化,所以气体平均相对分子质量一直在变化,所以容器中气体的平均相对分子质量不随时间而变化可以说明反应已达平衡状态,④项符合题意;答案②④。