��Ŀ����
����Ŀ����̿������м�ͻ���̿�Ļ������������۾������ڴ���ˮ����Ⱦ�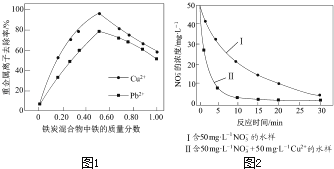
��1����̿�������ˮ��Һ�п��γ�������أ�������Cr2O72�������Է�ˮͨ����̿���������������Cr2O72��ת��ΪCr3+ �� ��缫��ӦʽΪ ��
��2������ͬ�����£�������������ͬ����������������ͬ����̿������ˮ��Cu2+��Pb2+��ȥ���ʣ������ͼ1��ʾ��
�ٵ���̿�������������������Ϊ0ʱ��Ҳ��ȥ��ˮ��������Cu2+��Pb2+ �� ��ԭ���� ��
�ڵ���̿�����������������������50%ʱ�����������������������ӣ�Cu2+��Pb2+��ȥ���ʲ�������������Ҫԭ���� ��
��3���������ۿ����ڴ�������ˮ�е���Ⱦ�
��һ�������£���FeSO4��Һ�еμӼ���NaBH4��Һ����Һ��BH4����BԪ�صĻ��ϼ�Ϊ+3����Fe2+��Ӧ�����������ۡ�H2��B��OH��4�� �� �����ӷ���ʽΪ ��
������������ˮ��NO3����Ӧ�����ӷ���ʽΪ:4Fe+NO3��+10H+�T4Fe2++NH4++3H2O��
�о����֣���pHƫ�ͽ��ᵼ��NO3����ȥ�����½�����ԭ���� ��
����ͬ�����£���������ȥ����ͬˮ����NO3���������нϴ���죨��ͼ2���������ò���Ŀ���ԭ���� ��
���𰸡�
��1��Cr2O72��+14H++6e��=2Cr3++7H2O
��2������̿��Cu2+��Pb2+�����������ã������������������ӣ�̼��������������Ŀ����
��3��2Fe2++BH4��+4OH��=2Fe+2H2��+B��OH��4�������������������ӷ�Ӧ����������Cu��Cu2+����������ȥ��NO3���ķ�Ӧ�����γ�Fe��Cuԭ���������������ȥ��NO3���ķ�Ӧ���ʣ�
����������1����������Һ�У�������Cr2O72��ת��ΪCr3+ �� ������ԭ��Ӧ���ʴ�Ϊ��Cr2O72��+14H++6e��=2Cr3++7H2O��
��2���ٵ���̿�������������������Ϊ0ʱ����ֻ��̼�ۣ���ȥ��ˮ��������Cu2+��Pb2+ �� ԭ����̼�۾��������ԣ��ʴ�Ϊ������̿��Cu2+��Pb2+�����������ã������������������������ӣ��γɵ������Ŀ���٣���Ӧ���ʼ�С����Cu2+��Pb2+��ȥ���ʲ����������ʴ�Ϊ�������������������ӣ�̼��������й������Ŀ���٣�
��3������FeSO4��Һ�еμӼ���NaBH4��Һ����Һ��BH4����BԪ�صĻ��ϼ�Ϊ+3����Fe2+��Ӧ�����������ۡ�H2��B��OH��4�� �� ��Ӧ��ֻ��Fe��HԪ�ػ��ϼ۷����仯������������ԭ��Ӧ �� �ʴ�Ϊ��2Fe2++BH4��+4OH��=2Fe+2H2��+B��OH��4����
��pHƫ�ͣ�������Ũ��ƫ���������������ӷ�Ӧ�����������ɵ���NO3����ȥ�����½����ʴ�Ϊ�����������������ӷ�Ӧ����������
����ͼ2��֪ͭ����Ũ��Խ��ȥ����Խ��ͭ���ӿ������ã�Ҳ�����γ�ԭ��ط�Ӧ���ʴ�Ϊ��Cu��Cu2+����������ȥ��NO3���ķ�Ӧ�����γ�Fe��Cuԭ���������������ȥ��NO3���ķ�Ӧ���ʣ���
��1��������Cr2O72��ת��ΪCr3+ �� ������ԭ��Ӧ����ϵ���غ���д�缫����ʽ����2���ٵ���̿�������������������Ϊ0ʱ����ֻ��̼�ۣ�̼�۾��������ԣ���ȥ��ˮ��������Cu2+��Pb2+�������������������������ӣ��γɵ������Ŀ���٣���Cu2+��Pb2+��ȥ���ʲ�����������3������FeSO4��Һ�еμӼ���NaBH4��Һ����Һ��BH4����BԪ�صĻ��ϼ�Ϊ+3����Fe2+��Ӧ�����������ۡ�H2��B��OH��4�� �� ��Ӧ��ֻ��Fe��HԪ�ػ��ϼ۷����仯����������غ㡢����غ��д�����ӷ���ʽ����pHƫ�ͣ�������Ũ��ƫ���������������ӷ�Ӧ��������������ͼ2��֪ͭ����Ũ��Խ��ȥ����Խ��ͭ���ӿ������ã�Ҳ�����γ�ԭ��ط�Ӧ�����⿼�����ʵķ��롢�ᴿ�������ڻ�ѧ���������Ŀ��飬��Ŀ����������ѧ�������õĿ�ѧ�����������ڿ���ѧ���ķ�����ʵ��������ע����������Ϣ�Լ����ʵ����ʣ�Ϊ������Ĺؼ����Ѷ��еȣ�

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����������ۺ������ǣ� ��
ѡ�� | ��ѧ��Ӧ�������ӷ���ʽ | ���� |
A | ����ϡ���ᷴӦ�� | ��ȷ |
B | ����ʯ���ڴ���ķ�Ӧ�� | ������ӦдΪ������ʽCH3COOH��CaCO3Ӧд��������ʽ |
C | FeCl3��Һ����ʴ��ͭ���� | ��ȷ |
D | NH4HCO3��Һ�����NaOHŨ��Һ���ȣ�NH4++OH�� | ����HCO3��Ҳ������OH����Ӧ |
A.A
B.B
C.C
D.D
����Ŀ��ijʵ��С��ͬѧģ�ҵ�Ƶ�ķ�����̽��ClO3����I���ķ�Ӧ���ɣ�ʵ����������������
ʵ�鼰�Լ� | ��� | ��ɫNaClO3 | �Թ��� | ����KI |
| 1 | 0.05 mL | dz��ɫ | ��ɫ |
2 | 0.20 mL | ���ɫ | ��ɫ | |
3 | 0.25 mL | dz��ɫ | ��ɫ | |
4 | 0.30 mL | ��ɫ | ��ɫ |
��1��ȡʵ��2�����Һ��������ͼʵ�飺 
�����飬������ɫ������AgCl��д������0.20mL NaClO3����Һ��ClO3����I��������Ӧ�����ӷ���ʽ�� ��
��2���������ϣ�һ�������£�I����I2�����Ա�������IO3�� ��
�������裺NaClO3��Һ�������ӵ�����Һ��ɫ��ԭ���ǹ�����NaClO3��Һ�루1��
�еķ�Ӧ���������Ӧ��ͬʱ����Cl2 ��
����ʵ�飺
��ȡ����ʵ��4�е���ɫ��Һ������ͼʵ�飬��һ����֤���к���IO3�� �� 
�����Լ�X������������ĸ��ţ���
a����ˮb��KMnO4��Һc��NaHSO3��Һ
����ͬѧ�������ͨ��ʪ�����KI��ֽ������������˵������Cl2 �� �㲹��������ʵ�飺��ʵ��4�е�ʪ�����KI��ֽ�滻Ϊʪ��ĵ�����ֽ���ٵμ�0.30mL 1.33molL��1NaClO3��Һ����ʪ��ĵ�����ֽû�����Ա仯���������϶Ա�ʵ���Ŀ���� �� ��һ����֤ʵ��4��������Cl2 �� ��ý��ۣ�NaClO3��Һ�������ӵ�����Һ��ɫ��ԭ�����������ӷ���ʽ��ʾ����
��3��С��ͬѧ����ʵ�飬ͨ���ı�ʵ��4��������Һ��������������ʵ������
��� | 6.0 molL��1 H2SO4��Һ���� | �Թ�����Һ��ɫ | ����KI��ֽ��ɫ |
5 | 0.25 mL | dz��ɫ | ��ɫ |
6 | 0.85 mL | ��ɫ | ��ɫ |
�ٶԱ�ʵ��4��5�����Ի�õĽ����� ��
�������ӷ���ʽ����ʵ��6������ ��