题目内容
 (2013?江苏三模)在5-氨基四唑(
(2013?江苏三模)在5-氨基四唑(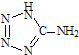 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.(1)基态Ga原子的电子排布式可表示为
[Ar]3d104s24p1
[Ar]3d104s24p1
;(2)5-氨基四唑中所含元素的电负性由大到小的顺序为
N>C>H
N>C>H
,其中N原子的杂化类型为sp2、sp3
sp2、sp3
;在1mol 5-氨基四唑中含有的σ键的数目为9NA
9NA
.(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为
直线型
直线型
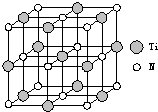
.②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为
Ti4CN3
Ti4CN3
.分析:(1)Ga是31号元素,其核外有31个电子,根据构造原理写出其核外电子排布式;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;根据价层电子对互斥理论确定其杂化方式;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)①根据价层电子对互斥理论确定其空间构型;
②利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式.
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;根据价层电子对互斥理论确定其杂化方式;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)①根据价层电子对互斥理论确定其空间构型;
②利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式.
解答:解:(1)Ga是31号元素,其核外有31个电子,根据构造原理知,其核外电子排布式为:[Ar]3d104s24p1
,故答案为:[Ar]3d104s24p1;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
含有两个共价单键和一个孤电子对的N原子其杂化方式是sp2,含有三个共价单键和一个孤电子对的N原子其杂化方式是sp3;
共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;sp2、sp3;9NA;
(3)①N3-中价层电子对=2+
(5+1-2×3)=2,且该离子中不含孤电子对,所以其空间构型是直线型,故答案为:直线型;
②该晶胞中碳原子个数=8×
=1,N原子个数=6×
=3,Ti原子个数=1+12×
=4,所以其化学式为:Ti4CN3,故答案为:Ti4CN3.
,故答案为:[Ar]3d104s24p1;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
含有两个共价单键和一个孤电子对的N原子其杂化方式是sp2,含有三个共价单键和一个孤电子对的N原子其杂化方式是sp3;
共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;sp2、sp3;9NA;
(3)①N3-中价层电子对=2+
| 1 |
| 2 |
②该晶胞中碳原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
点评:本题考查电负性、化学式的确定、杂化方式的判断等知识点,会运用价层电子对互斥理论确定杂化方式和空间构型,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下: