题目内容
【题目】铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知:
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为______
(2)镁铝合金生活中应用广泛。取样品a克,溶于200mL5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围_____,向反应后溶液中加入4mol/L NaOH溶液____mL,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mLO2后,可完全被H2O吸收,无气体剩余。则生成的NO为_________mL;向反应后溶液加足量的NaOH溶液,得到沉淀的质量____________ g。(用含a的代数式表示)
(4)如图所示,A,F为石墨电极,B,E为铁片电极。按要求回答下列问题。
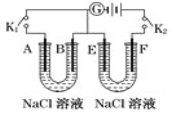
①打开K2,闭合K1,B为____极, A的电极反应式为:_________________________。
②打开K1,闭合K2,E为_____极,F极的电极反应式为:______________________ 。
【答案】Cu(s) +2H+ (aq) + H2O2(l) = Cu2+(aq) + 2H2O(l) △H= -319.68 kJ/mol 2.7<a<3.6 250 89.6 a+0.204 负 O2+4e-+2H2O=4OH- 阴 2Cl--2e-=Cl2↑
【解析】
(1)依据热化学方程式和盖斯定律分析解答;
(2)根据极限法求出极限点,当氢气的量一定时,合金全为Mg时合金质量最大,当合金全为Al时合金质量最小;当沉淀质量达到最大值时,溶液中只有氯化钠溶质,据此分析计算;
(3)根据方程式4NO + 3O2 + 2H2O =4HNO3,求出反应生成的NO的量;向反应后溶液加足量的NaOH溶液,反应后,体系中含有硝酸钠和氢氧化钠溶液,氢氧化铁和氢氧化铜沉淀,结合的氢氧根离子的物质的量与反应过程中转移的电子相等,据此分析计算沉淀的质量;
(4)①当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,据此分析解答;②当打开K1,闭合K2时,铁片、石墨和NaCl溶液构成电解池,据此分析解答。
(1)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol,②2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ/mol,③H2(g)+ ![]() O2(g)=H2O(l) △H=-285.84kJ/mol,依据盖斯定律①+
O2(g)=H2O(l) △H=-285.84kJ/mol,依据盖斯定律①+![]() ②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=(+64.39kJ/mol)+(-196.46kJ/mol)×
②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=(+64.39kJ/mol)+(-196.46kJ/mol)×![]() +(-285.84kJ/mol)=-319.6kJ/mol,故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.6kJ/mol;
+(-285.84kJ/mol)=-319.6kJ/mol,故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.6kJ/mol;
(2)标况下3.36L氢气物质的量为![]() =0.15mol,则反应的氢离子的物质的量为0.15×2=0.3mol,HCl溶液中HCl物质的量为0.2L×5mol/L=1mol,则盐酸未完全反应。根据Mg和Al与盐酸的反应可知,当氢气的量一定时,合金全为Mg时合金质量最大,全为Al时合金质量最小,
=0.15mol,则反应的氢离子的物质的量为0.15×2=0.3mol,HCl溶液中HCl物质的量为0.2L×5mol/L=1mol,则盐酸未完全反应。根据Mg和Al与盐酸的反应可知,当氢气的量一定时,合金全为Mg时合金质量最大,全为Al时合金质量最小,
Mg~~~~H2
0.15mol 0.15mol
2Al~~~~3H2
0.1mol 0.15mol
两种状况下合金的质量分别为:Mg:0.15mol×24g/mol=3.6g,Al:0.1mol×24g/mol=2.7g,即a的取值范围为2.7<a<3.6;向反应后溶液中加入4mol/L NaOH溶液,当沉淀质量达到最大值时,溶液中只有氯化钠溶质,则氢氧化钠与盐酸的物质的量相等,因此V(NaOH)=![]() =0.25L=250mL,故答案为:2.7<a<3.6;250;
=0.25L=250mL,故答案为:2.7<a<3.6;250;
(3)标准状况下,67.2mLO2的物质的量=![]() =0.003mol,根据方程式4NO + 3O2 + 2H2O =4HNO3,反应生成的NO的物质的量为0.004mol,在标准状况下的体积=0.004mol×22.4L/mol=0.0896L=89.6mL;向反应后溶液加足量的NaOH溶液,反应后,体系中含有硝酸钠和氢氧化钠溶液,氢氧化铁和氢氧化铜沉淀,结合的氢氧根离子的物质的量与反应过程中转移的电子相等,则n(OH-)=3n(NO)=3×0.004mol=0.012mol,因此沉淀的质量=ag+0.012mol×17g/mol=(a+0.204)g,故答案为:89.6;a+0.204;
=0.003mol,根据方程式4NO + 3O2 + 2H2O =4HNO3,反应生成的NO的物质的量为0.004mol,在标准状况下的体积=0.004mol×22.4L/mol=0.0896L=89.6mL;向反应后溶液加足量的NaOH溶液,反应后,体系中含有硝酸钠和氢氧化钠溶液,氢氧化铁和氢氧化铜沉淀,结合的氢氧根离子的物质的量与反应过程中转移的电子相等,则n(OH-)=3n(NO)=3×0.004mol=0.012mol,因此沉淀的质量=ag+0.012mol×17g/mol=(a+0.204)g,故答案为:89.6;a+0.204;
(4)①当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,负极为铁,电极反应式为:Fe-2e-═Fe2+,正极为石墨,电极反应式为:O2+4e-+2H2O═4OH-,由于Fe2++2OH-═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3,故答案为:负;O2+4e-+2H2O═4OH-;
②当打开K1,闭合K2时,铁片、石墨和NaCl溶液构成电解池,阴极为铁,电极反应式为:2H++2e-═H2↑,阳极为石墨,电极反应式为:2Cl--2e-═Cl2↑,故答案为:阴;2Cl--2e-═Cl2↑。

 阅读快车系列答案
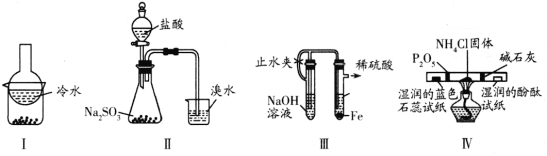
阅读快车系列答案【题目】某小组设计实验对硫燃烧的产物及其性质进行验证,实验装置如下图所示。
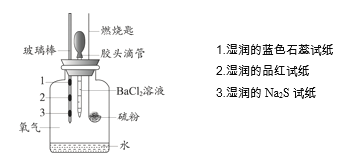
下列实验事实与所得结论相符的是
实验事实 | 所得结论 | |
A | 湿润的品红试纸褪色 | 证明硫燃烧的产物中有SO2 |
B | 湿润的Na2S试纸上出现淡黄色固体 | 证明硫的燃烧产物能被还原成硫 |
C | 湿润的蓝色石蕊试纸变红 | 证明硫的燃烧产物中有酸类物质 |
D | 加入BaCl2溶液产生白色沉淀 | 证明硫燃烧的产物中有SO3 |
A.AB.BC.CD.D