题目内容
19.下列离子方程式正确的是( )| A. | 用石墨作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| B. | Fe3O4与过量的稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
分析 A.电解食盐水生成NaOH、氢气、氯气;
B.发生氧化还原反应生成硝酸铁、NO和水;
C.至溶液恰好为中性,生成硫酸钡、硫酸钠和水;
D.水解分步进行,以第一步为主.
解答 解:A.用石墨作电极电解饱和食盐水的离子反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,故A正确;
B.Fe3O4与过量的稀HNO3反应的离子反应为NO3-+3Fe3O4+28H+═9Fe3++NO↑+14H2O,故B错误;
C.向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至溶液恰好为中性的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.Na2S溶液呈碱性的水解离子反应为S2-+H2O?HS-+OH-,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重电解反应、氧化还原反应、水解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
11.在一容积可变的密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(g)+4H2(g),下列有关叙述正确的是( )
| A. | 增加Fe的量,正反应速率增大 | |
| B. | 将容器的体积缩小一半,正逆反应速率增大 | |
| C. | 保持体积不变,充入Ne,正逆反应速率增大 | |
| D. | 保持压强不变,充入Ne,正逆反应速率不变 |
7.合成氯是人类研究的重要课题,目前工业合成氨的原理为:N2(g)+3H2(g) $?_{催化剂}^{高温、高压}$2NH3(g)△H=-93.0kJ/mol
某温度下,在2L密闭容器中发生上述反应,测得数据如下
①0~2h内,v(N2)=0.075 mol•L-1•h-1.
②平衡时,H2的转化率为205
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为CD(填选项字母).
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2.
某温度下,在2L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
②平衡时,H2的转化率为205
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为CD(填选项字母).
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2.
14. 某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:
某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:
A(s)+2B(g)?D(g)+E(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
(1)T1℃时,该反应的平衡常数K=0.25;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ad(填字母编号).
a.通入一定量的B b.加入一定量的固体A
c.升高反应体系温度 d.同时加入0.2molB、0.1molD、0.1molE
(3)维持容器的体积和温度T1不变,当向该容器中加入1.60molB、0.20molD、0.20molE和n molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n应不少于0.3mol.
(4)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a=1.5.
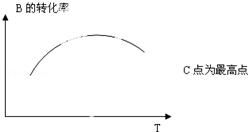
(5)若该密闭容器绝热,实验测得B的转化率B%随温度变化的示意图如图所示.由图可知,Q<0 (填<、>、=),c点v(正)=v(逆)(填<、>、=).
 某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:
某研究小组向2L密闭容器中加入一定量的固体A和气体B发生反应:A(s)+2B(g)?D(g)+E(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ad(填字母编号).
a.通入一定量的B b.加入一定量的固体A
c.升高反应体系温度 d.同时加入0.2molB、0.1molD、0.1molE
(3)维持容器的体积和温度T1不变,当向该容器中加入1.60molB、0.20molD、0.20molE和n molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n应不少于0.3mol.
(4)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a=1.5.
(5)若该密闭容器绝热,实验测得B的转化率B%随温度变化的示意图如图所示.由图可知,Q<0 (填<、>、=),c点v(正)=v(逆)(填<、>、=).
11.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 32gO2和32gO3所含分子数目都为NA | |
| B. | 标准状况下,11.2 L水中含有的原子数是1.5NA | |
| C. | 0.1mol Fe参与化学反应转移的电子数一定为0.3NA | |
| D. | 标准状况下,5.6L氯气和16.8L氧气混合气体中含有的分子数为NA |
 铝及其化合物在生产、生活中有着广泛的应用.回答下列问题:
铝及其化合物在生产、生活中有着广泛的应用.回答下列问题: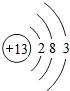 ..
.. .
.