题目内容
4. 铝及其化合物在生产、生活中有着广泛的应用.回答下列问题:
铝及其化合物在生产、生活中有着广泛的应用.回答下列问题:(1)铝原子的结构示意图为
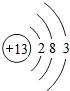 ..
..(2)工业上用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝.每生产1t Al,阳极大约会损失0.6t石墨.则石墨被氧化为CO和CO2(填化学式).
(3)纳米氧化铝用于透明陶瓷、高压钠灯灯管等.纳米氧化铝分散在分散剂中将形成胶体.则纳米氧化铝颗粒的直径约为10-9~10-7m,制取纳米氧化铝需要纯净的硫酸铝,检验硫酸铝溶液中是否含有Fe3+操作方法和现象是加KSCN溶液,溶液变血红色.
(4)电解法制备高品质AI(OH)3的装置如图(中间用离子交换膜隔开),其反应原理为:
4NaAlO2+10H2O$\frac{\underline{\;电解\;}}{\;}$4Al(OH)3↓+4NaOH+O2↑+2H2↑则Al(OH)3在阳极(填“阴极”或“阳极”)区沉积,电路中每通过2mol e时,理论上可制得2mol Al(OH)3.
分析 (1)原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层,铝为13号元素;
(2)用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,石墨被氧化产物可能为CO或者CO2,或者二者混合物,设石墨被氧化后的价态为+n价,则:C→Cn+~ne-,Al3+→Al~3e-,依据氧化还原反应中得失电子守恒计算;
(3)胶体微粒直径在1nm~100nm之间;用KSCN溶液检验溶液中Fe3+;
(4)电解本质是电解水,阴极上水放电生成氢气与氢氧根离子,阳极上水放电生成生成氧气与氢离子,氢离子再与[Al(OH)4]-反应生成Al(OH)3;根据电子转移守恒计算生成氧气物质的量,再根据方程式计算生成Al(OH)3的物质的量.
解答 解:(1)铝为13号元素,该元素原子核内有13个质子,原子核外有3个电子层,原子的结构示意图为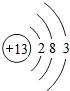 ,
,
故答案为: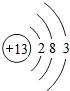 ;
;
(2)每生产1吨Al转移的电子数为$\frac{1T}{27}$×3,0.6吨的石墨失去的电子数为:$\frac{0.6T}{12}$×n,依据氧化还原反应中得失电子守恒:$\frac{1T}{27}$×3=$\frac{0.6T}{12}$×n,得n≈2.2,2<2.2<4,所以石墨被氧化为CO和CO2混合物.
故答案为:CO和CO2;
(3)胶体微粒直径在1nm~100nm之间,则纳米氧化铝的直径约为10-9~10-7m,检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是:加KSCN溶液,溶液变血红色,
故答案为:10-9~10-7;加KSCN溶液,溶液变血红色;
(4)电解本质是电解水,阴极上水放电生成氢气与氢氧根离子,阳极上水放电生成生成氧气与氢离子,氢离子再与[Al(OH)4]-反应生成Al(OH)3,故产物Al(OH)3在阳极区沉积,根据电子转移守恒,生成氧气物质的量为$\frac{2mol}{4}$=0.5mol,由:4Na[Al(OH)4]+2H2O $\frac{\underline{\;电解\;}}{\;}$4Al(OH)3↓+4NaOH+O2↑+2H2↑,可知生成Al(OH)3的物质的量为0.5mol×4=2mol,
故答案为:阳极;2.
点评 本题考查了铝原子的结构、氧化还原反应产物的判断,离子的检验、电解的产物判断等知识,是对学生综合能力的考查,明确氧化还原反应中得失电子守恒的规律是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
参考上述信息,找出下列说法中不正确的是( )
| A. | 该反应属于取代反应,CPAE含有三类官能团 | |
| B. | CPAE的分子式为C17H16O4 | |
| C. | 苯乙醇属于醇类,含有苯环的醇类同分异构体有四种 | |
| D. |  与咖啡酸互为同分异构体 与咖啡酸互为同分异构体 |
| A. | 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 | |
| B. | 2H2(g)+O2(g)═2H2O(l);△H1=-akJ•mol-1,则氢气燃烧热为akJ•mol-1 | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 | |
| D. | N2(g)+3H2(g)═2NH3(g);△H=-akJ•mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
| A. | 用石墨作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| B. | Fe3O4与过量的稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ------ |
(1)铝热反应是氧化还原反应,在反应中金属被氧化(填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为NaOH溶液,可观察到的实验现象为:有无色气体放出.
(3)实验室欲溶解此熔融物,下列试剂中最好的是B(填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLPH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLPH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A. | 原合金的质量为0.92g | B. | 图中V2为60 | ||
| C. | 整个滴定过程Na+的浓度保持不变 | D. | 合金中Na与Al物质的量之比为2:1 |
| A. | 加入少量NaOH固体,c(CH3COO-)减小 | |
| B. | 加入少量FeCl3固体,c(CH3COO-)减小 | |
| C. | 稀释溶液,溶液的pH增大 | |
| D. | 加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |