题目内容
7.合成氯是人类研究的重要课题,目前工业合成氨的原理为:N2(g)+3H2(g) $?_{催化剂}^{高温、高压}$2NH3(g)△H=-93.0kJ/mol某温度下,在2L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
②平衡时,H2的转化率为205
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为CD(填选项字母).
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2.
分析 ①0~2h内,消耗氮气为2mol-1.7mol=0.3mol,再根据v=$\frac{△c}{△t}$计算v(N2);
②3h到达平衡状态,消耗氢气为6mol-4.8mol=1.2mol,转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
③若保持温度和体积不变,改变起始投入量,达到平衡后,NH3的浓度与原平衡相同,说明为等效平衡,反应前后气体体积不相等,恒温恒容下,按化学计量转化到方程式左边满足n(N2)=2mol、n(H2)=6mol.
解答 解:①0~2h内,消耗氮气为2mol-1.7mol=0.3mol,则v(N2)=$\frac{\frac{0.3mol}{2L}}{2h}$=0.075 mol•L-1•h-1,
故答案为:0.075 mol•L-1•h-1;
②3h到达平衡状态,消耗氢气为6mol-4.8mol=1.2mol,平衡时氢气转化率=$\frac{1.2mol}{6mol}$×100%=20%,
故答案为:20%;
③若保持温度和体积不变,改变起始投入量,达到平衡后,NH3的浓度与原平衡相同,说明为等效平衡,反应前后气体体积不相等,恒温恒容下,按化学计量转化到方程式左边满足n(N2)=2mol、n(H2)=6mol,A、B选项不符合,C、D中转化到方程式左边可以得到n(N2)=2mol、n(H2)=6mol,
故选:CD.
点评 本题考查化学平衡计算、等效平衡,难度中等,注意理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列有关热化学方程式的叙述正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 | |
| B. | 2H2(g)+O2(g)═2H2O(l);△H1=-akJ•mol-1,则氢气燃烧热为akJ•mol-1 | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 | |
| D. | N2(g)+3H2(g)═2NH3(g);△H=-akJ•mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
2.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气.已知:
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是 …( )
N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是 …( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ•mol-1 |
19.下列离子方程式正确的是( )
| A. | 用石墨作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| B. | Fe3O4与过量的稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
16. 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLPH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLPH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLPH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mLPH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A. | 原合金的质量为0.92g | B. | 图中V2为60 | ||
| C. | 整个滴定过程Na+的浓度保持不变 | D. | 合金中Na与Al物质的量之比为2:1 |
17.分析如图的能量变化示意图,下列热化学方程式正确的是( )


| A. | 2 A(g)+B(g)=2 C(g);△H=a(a>0) | B. | 2 A(g)+B(g)=2 C(g);△H=a(a<0) | ||
| C. | 2A+B=2 C;△H=a(a<0) | D. | 2 C=2 A+B;△H=a(a>0) |
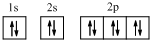 .
.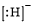 ,BE5含有的化学键类型有ABD(选填代号:A.离子键 B.极性键 C.非极性键 D.配位键).
,BE5含有的化学键类型有ABD(选填代号:A.离子键 B.极性键 C.非极性键 D.配位键).


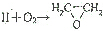 是原子利用率为100%的转化,Ⅱ的结构简式为CH2=CH2,
是原子利用率为100%的转化,Ⅱ的结构简式为CH2=CH2, 在一定条件下发生聚合反应生成聚酰胺类高分子化合物,写出该反应的化学方程式
在一定条件下发生聚合反应生成聚酰胺类高分子化合物,写出该反应的化学方程式 .
. )利用本题的信息,设计合成方案,用流程图表示并注明反应条件.例如,由乙醇合成聚乙烯的反应流程图可表示为:
)利用本题的信息,设计合成方案,用流程图表示并注明反应条件.例如,由乙醇合成聚乙烯的反应流程图可表示为: ,则反应的流程图为
,则反应的流程图为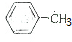 $→_{光照}^{氯气}$
$→_{光照}^{氯气}$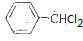 $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$ $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$ 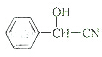 $→_{H_{2}O}^{H+}$
$→_{H_{2}O}^{H+}$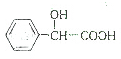 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$