题目内容
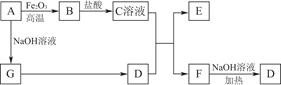
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”)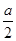 mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。

请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”)
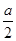 mol/L。
mol/L。③该条件下的平衡常数为__________________(用含a的代数式表示)。
(1)[H∶N?,?H,H ∶H]+[∶Cl?,?∶]-
(2)①Al3++3NH3·H2O=Al(OH)3↓+3NH4+
②NH4Cl+NaOH NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
(3)①Al3++3H2O??Al(OH)3+3H+
②c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(4)D
(5)①0.8 ②小于
③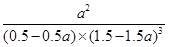 或
或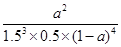
(2)①Al3++3NH3·H2O=Al(OH)3↓+3NH4+
②NH4Cl+NaOH
 NaCl+NH3↑+H2O
NaCl+NH3↑+H2O(3)①Al3++3H2O??Al(OH)3+3H+
②c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(4)D
(5)①0.8 ②小于
③
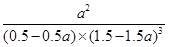 或
或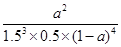
由A为单质且能与NaOH溶液和Fe2O3反应可知A为Al,则B为Al2O3,C为AlCl3;由D是能使湿润的红色石蕊试纸变蓝色的气体可知D为NH3,则G为H2,E为Al(OH)3,F为NH4Cl。(1)NH4Cl为离子化合物,NH4+离子中含有四个N-H共价键,故其电子式为[H∶N?,?H,H ∶H]+[∶Cl?,?∶]-。(2)NH3·H2O是弱电解质,不能拆开写,与Al3+反应产物为Al(OH)3。(3)①AlCl3为强酸弱碱盐,水解显酸性;②NH4Cl为强酸弱碱盐,水解显酸性,且其水解反应以及水的电离反应都是程度很微弱的反应,故溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)。(4)Al与HNO3溶液反应产物为NO或NO2,不是单质,A项错误;0.2 mol Al与0.4 mol的H2SO4溶液或NaOH溶液反应时Al可以反应完全,B、C项错误;D项正确。(5)该反应为N2(g)+3H2(g) 2NH3(g)。①v(NH3)=
2NH3(g)。①v(NH3)=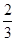 v(H2)=0.8 mol/(L·min);②与原平衡相比,起始时充入0.5 mol N2和1.5 mol G相当于减小压强,平衡向逆反应方向移动,故D的物质的量浓度小于
v(H2)=0.8 mol/(L·min);②与原平衡相比,起始时充入0.5 mol N2和1.5 mol G相当于减小压强,平衡向逆反应方向移动,故D的物质的量浓度小于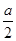 mol/L;③由题目所给数据可得该反应的三段式:
mol/L;③由题目所给数据可得该反应的三段式:
N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
起始浓度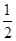 mol/L
mol/L 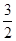 mol/L 0
mol/L 0
浓度变化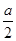 mol/L
mol/L 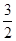 a mol/L a mol/L
a mol/L a mol/L
平衡浓度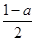 mol/L
mol/L 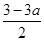 mol/L a mol/L
mol/L a mol/L
则K=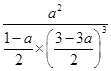 。
。
 2NH3(g)。①v(NH3)=
2NH3(g)。①v(NH3)=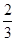 v(H2)=0.8 mol/(L·min);②与原平衡相比,起始时充入0.5 mol N2和1.5 mol G相当于减小压强,平衡向逆反应方向移动,故D的物质的量浓度小于
v(H2)=0.8 mol/(L·min);②与原平衡相比,起始时充入0.5 mol N2和1.5 mol G相当于减小压强,平衡向逆反应方向移动,故D的物质的量浓度小于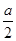 mol/L;③由题目所给数据可得该反应的三段式:
mol/L;③由题目所给数据可得该反应的三段式:N2(g) + 3H2(g)
 2NH3(g)
2NH3(g)起始浓度
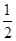 mol/L
mol/L 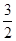 mol/L 0
mol/L 0浓度变化
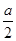 mol/L
mol/L 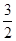 a mol/L a mol/L
a mol/L a mol/L平衡浓度
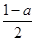 mol/L
mol/L 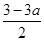 mol/L a mol/L
mol/L a mol/L则K=
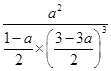 。
。
练习册系列答案
相关题目

 Mg(OH)2
Mg(OH)2 Mg
Mg MgCl2溶液→MgCl2晶体
MgCl2溶液→MgCl2晶体 Mg(OH)2
Mg(OH)2 MgO
MgO
 测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
测定剩余固体质量,实验中发生反应的化学方程式是_________________________。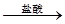 测定生成气体的体积实验装置:
测定生成气体的体积实验装置: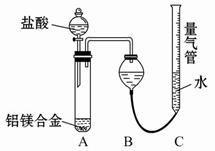


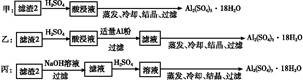
 CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;