题目内容
如图是测定铝粉(含镁粉)的纯度的实验装置。所用的NaOH(足量)的物质的量浓度为4.5 mol·L-1。不同时间电子天平的读数如下表所示:

(1)反应中生成气体的质量 g。
(2)试计算样品中铝的质量分数。(写出解题过程)
(3)反应后溶液(溶液的体积变化忽略)的c(OH-)。(写出解题过程)

| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 0 | 120 |
| 烧杯+NaOH溶液+样品 | 0 | 135 |
| 1 | 134.5 | |
| 2 | 134.1 | |
| 3 | 133.8 | |
| 4 | 133.8 |
(1)反应中生成气体的质量 g。
(2)试计算样品中铝的质量分数。(写出解题过程)
(3)反应后溶液(溶液的体积变化忽略)的c(OH-)。(写出解题过程)
(1)1.2 (2)72% (3)0.5mol·l-1
试题解析:(1)根据质量守恒定律可得生成气体的质量为:135g-133.8=1.2g
(2)根据生成的氢气的质量可以算出参加反应的铝的质量也即样品中铝的质量,从而可计算样品中铝的质量分数。
(3)同理根据氢气的质量可以计算出参加反应的NaOH的物质的量,用原有NaOH的物质的量减去用去的即是剩余的NaOH的物质的量,除以溶液的体积即可求出NaOH的物质的量浓度,即为所求。
(2)解:设样品中铝的质量为x,则
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54 6
x 1.2g
得: x= 10.8g
所以样品中铝的质量分数为:10.8g/(135-120)g=0.72
(3)解:100ml氢氧化钠溶液中原有NaOH物质的量为0.45mol,设与铝反应消耗的NaOH的物质的量为y,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 6g
Y 1.2g
解得:y=0.4mol
溶液中剩余0.45-0.4=0.05mol的NaOH,
所以c(OH-)=0.05mol/0.1L=0.5mol·l-1

练习册系列答案
相关题目
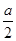 mol/L。
mol/L。
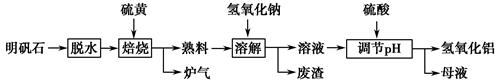
 Al2(SO4)3+
Al2(SO4)3+
