题目内容
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
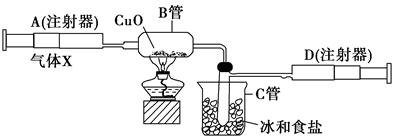
在注射器A中装有240 mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24 000 mL,则X的摩尔质量是________。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)________________________。

在注射器A中装有240 mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24 000 mL,则X的摩尔质量是________。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)________________________。
(1)氮 氢 (2)32 g/mol (3)N2H4
(4)N2H4+2CuO N2+2H2O+2Cu
N2+2H2O+2Cu
(4)N2H4+2CuO
 N2+2H2O+2Cu
N2+2H2O+2Cu实验时的温度和压强下,1 mol X气体的体积是24 000 mL,则反应消耗的X气体为0.01 mol,CuO为0.02 mol,N2为0.01 mol,H2O为0.02 mol。根据质量守恒定律,0.01 mol X气体的质量为0.32 g,其摩尔质量为32 g/mol;X气体是由N和H元素组成的,0.01 mol X分子中含有n(N)=0.01 mol×2=0.02 mol,n(H)=0.02 mol×2=0.04 mol,因此分子式为N2H4。

练习册系列答案
相关题目
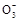 可和I-发生反应:I
可和I-发生反应:I 3I2+3H2O,根据此反应,可用试纸和一些生活中常见物质进行实验,证明食盐中存在I
3I2+3H2O,根据此反应,可用试纸和一些生活中常见物质进行实验,证明食盐中存在I