题目内容
【题目】A、B、C、D、E、F代表周期表中五种短周期元素,已知:
![]() 、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
![]() 与C处于周期表中同一周期,
与C处于周期表中同一周期,![]() 中各层电子数都是
中各层电子数都是![]() 个。
个。
![]() 、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
![]() 是半径最小的原子。据此填空下列空白:
是半径最小的原子。据此填空下列空白:
![]() 写出各元素的名称A ______ C ______ E ______
写出各元素的名称A ______ C ______ E ______
![]() 写出A和D形成化合物的电子式 ______
写出A和D形成化合物的电子式 ______
![]() 、C、D三种元素单原子离子的半径由大到小的顺序: ______
、C、D三种元素单原子离子的半径由大到小的顺序: ______
![]() 、B的氢化物的熔沸点大小并写出原因: ______
、B的氢化物的熔沸点大小并写出原因: ______
![]() 写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
【答案】氧 氯 硅 ![]()
![]()
![]()
![]() ;水中有氢键
;水中有氢键 ![]()
【解析】
A、B、C、D、E代表周期表中五种短周期元素,![]() 中各层电子数都是
中各层电子数都是![]() 个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是
个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是![]() 为正整数
为正整数![]() ,则B原子序数为
,则B原子序数为![]() ,C原子序数为为
,C原子序数为为![]() 或
或![]() ,
,![]() ,则
,则![]() 舍去
舍去![]() ,
,![]() ,
,![]() ,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数
,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数![]() ,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
![]() 由以上分析可知A为氧,C为氯,E为硅。
由以上分析可知A为氧,C为氯,E为硅。
![]() 和D形成化合物为过氧化钠、氧化钠。
和D形成化合物为过氧化钠、氧化钠。
![]() 电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小。
电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小。
![]() 水中含有氢键,较一般分子间作用力强。
水中含有氢键,较一般分子间作用力强。
![]() 、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl。
、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl。
A、B、C、D、E代表周期表中五种短周期元素,![]() 中各层电子数都是
中各层电子数都是![]() 个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是
个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是![]() 为正整数
为正整数![]() ,则B原子序数为
,则B原子序数为![]() ,C原子序数为为
,C原子序数为为![]() 或
或![]() ,
,![]() ,则
,则![]() 舍去
舍去![]() ,
,![]() ,
,![]() ,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数
,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数![]() ,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
![]() 由以上分析可知A为氧,C为氯,E为硅。答案为:氧;氯;硅;
由以上分析可知A为氧,C为氯,E为硅。答案为:氧;氯;硅;
![]() 和D形成化合物分别为过氧化钠、氧化钠,其电子式可分别表示为
和D形成化合物分别为过氧化钠、氧化钠,其电子式可分别表示为![]() 、
、![]() ;
;
![]() 电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,B、C、D离子分别是
电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,B、C、D离子分别是![]() 、
、![]() 、
、![]() ,硫离子和氯离子有3个电子层、钠离子有2个电子层,所以离子半径大小顺序是
,硫离子和氯离子有3个电子层、钠离子有2个电子层,所以离子半径大小顺序是![]() 。答案为:
。答案为:![]() ;
;
![]() 水中含有氢键,较一般分子间作用力强,水的沸点较高。答案为:
水中含有氢键,较一般分子间作用力强,水的沸点较高。答案为:![]() ;水中有氢键;
;水中有氢键;
![]() 、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl,反应方程式为
、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl,反应方程式为![]() 。答案为:
。答案为:![]() 。
。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
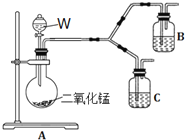
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。