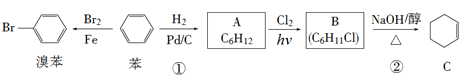
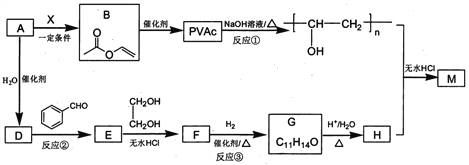
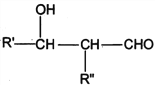
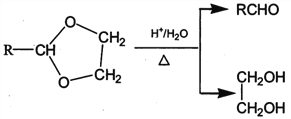
题目内容
【题目】已知:①:2C(s)+O2(g)═2CO(q)△H=﹣221.0kJ/mol②2H2(q)+O2(q)═2H2O(g)△H=﹣483.6kJ/mol,则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
A.262.6kJ/mol B.﹣131.3kJ/mol C.﹣352.3kJ/mol D.+131.3kJ/mol
【答案】D
【解析】
①:2C(s)+O2(g)═2CO(q)△H=﹣221.0kJ/mol②2H2(q)+O2(q)═2H2O(g)△H=﹣483.6kJ/mol,依据盖斯定律![]() 得到 C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ·mol-1;
得到 C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ·mol-1;
故选:D。

 同步奥数系列答案
同步奥数系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结 论 |
A | 向一定浓度的Na2SiO3 溶液中通入适量CO2 气体, 出现白色沉淀。 | H2SiO3 的酸性比H2CO3的酸性强 |
B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
C | 室温下,测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 | HSO3- 结合H+ 的能力比SO32-的强 |
D | 分别向25mL冷水和25mL沸水中滴入6滴FeCl3 饱和溶液,前者为黄色,后者为红褐色。 | 温度升高,Fe3+的水解程度增大 |
A.AB.BC.CD.D
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
Ⅰ. 已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka= 1.77×10-4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
(1)0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
(2)常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
(3)室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是___________。
Ⅱ. 室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

(4)d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
(5)b点所示的溶液中c(NH3·H2O) - c(NH4+)=______(用溶液中的其它离子浓度表示)。
Ⅲ. 已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
(6)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。