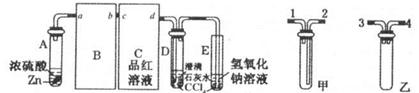
题目内容
已知Na2SO3固体与硫酸可发生反应:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,下图是实验室制取SO2并验证SO2的某些性质的装置图。试回答:
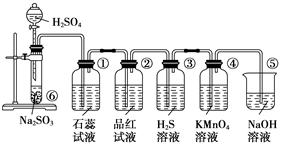 [
[
(1)①中的实验现象为紫色石蕊试液_________________,此实验证明SO2是________气体。
(2)②中的品红溶液___________________,证明SO2有__________性。
(3)③中的实验现象是_________________,证明SO2有__________性。
(4)④中的实验现象是_________________,证明SO2有__________性。
 [
[(1)①中的实验现象为紫色石蕊试液_________________,此实验证明SO2是________气体。
(2)②中的品红溶液___________________,证明SO2有__________性。
(3)③中的实验现象是_________________,证明SO2有__________性。
(4)④中的实验现象是_________________,证明SO2有__________性。
(1)变红,酸性
(2)褪色(或退色),漂白
(3)变浑浊(生成沉淀),氧化
(4)紫红色退去,还原
(2)褪色(或退色),漂白
(3)变浑浊(生成沉淀),氧化
(4)紫红色退去,还原
试题分析:(1)、SO2是酸性氧化物,石蕊试液中通入SO2时,SO2与H2O化合生成H2SO3,H2SO3电离出H+,使紫色石蕊变红,说明SO2是酸性气体;(2)、SO2通入品红溶液时,品红溶液褪色,说明SO2具有漂白性;(3)、SO2通入H2S溶液时,溶液变浑浊,生成黄色沉淀,硫元素由+4价降为0价,被还原,说明SO2是氧化剂,具有氧化性;(4)、SO2通入酸性高锰酸钾溶液时,溶液的紫红色褪去,硫元素由+4价升为+6价,被氧化,说明SO2是还原剂,具有还原性。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 2CuO,CuO+H2SO4=CuSO4+H2O。
2CuO,CuO+H2SO4=CuSO4+H2O。