题目内容
5.将0.2L 2mol/LH2SO4溶液和0.8L 1mol/LHCl溶液混合,往混合溶液中加入足量金属Fe,计算(不需要写计算过程)(1)混合溶液中H+物质的量为1.6mol;
(2)消耗的Fe的物质的量为0.4mol;
(3)消耗Fe的质量为22.4g;
(4)生成氢气的体积为(标准状况下)8.96L.
分析 (1)由电荷守恒可得:n(H+)=n(Cl-)+2n(SO42-);
(2)根据Fe+2H+=Fe2++H2↑计算;
(3)由m=nM计算Fe的质量;
(4)根据Fe+2H+=Fe2++H2↑计算氢气的物质的量,再计算体积.
解答 解:(1)0.2L 2mol/LH2SO4溶液和0.8L 1mol/LHCl溶液混合,由电荷守恒可得:n(H+)=n(Cl-)+2n(SO42-)=0.8L×1mol/L+0.2L×2mol/L×2=1.6mol;
故答案为:1.6mol;
(2)由反应Fe+2H+=Fe2++H2↑可知,n(Fe)=$\frac{1}{2}$n(H+)=0.4mol,故答案为:0.4mol;
(3)Fe的质量为m=nM=0.4mol×56g/mol=22.4g,故答案为:22.4g;
(4)由Fe+2H+=Fe2++H2↑可知,n(H2)=$\frac{1}{2}$n(H+)=0.4mol,则氢气的体积为0.4mol×22.4L/mol=8.96L,故答案为:8.96L.
点评 本题考查混合物计算、根据方程式计算,注意对公式的理解与灵活应用,注意电解混合溶液中常利用电荷守恒进行计算,难度中等.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
16.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
13.1个氧原子的质量是2.657×10-26kg,则32kgO2中所含O2的数目最接近于( )
| A. | 3.01×1023 | B. | 5.32×1026 | C. | 6.02×1026 | D. | 1.2×1026 |
10.下列有关铁的化学反应中,与事实不符的是( )
| A. | 铁和硫酸铜溶液反应得到铜 | |
| B. | 铁和稀盐酸反应生成H2和FeCl2 | |
| C. | 铁高温下和水蒸气反应生成H2和Fe2O3 | |
| D. | 铁在氧气中燃烧生成Fe3O4 |
6.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:

下列推断不合理的是( )

下列推断不合理的是( )
| A. | 通入CO2和NH3顺序可以颠倒 | |
| B. | 通入的NH3必须过量 | |
| C. | CO2可被循环使用 | |
| D. | 生成1mol(NH4)2SO4至少消耗2 mol NH3 |
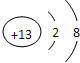 Al3+; 碳酸氢根离子HCO3-;次氯酸钙Ca(ClO)2
Al3+; 碳酸氢根离子HCO3-;次氯酸钙Ca(ClO)2