题目内容
6.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断不合理的是( )
| A. | 通入CO2和NH3顺序可以颠倒 | |
| B. | 通入的NH3必须过量 | |
| C. | CO2可被循环使用 | |
| D. | 生成1mol(NH4)2SO4至少消耗2 mol NH3 |
分析 CaSO4悬浊液中通入足量NH3,氨气极易溶于水,氨气和水反应生成NH3.H2O;然后向溶液中通入适量CO2,发生的反应为2NH3+H2O+CO2=(NH4)2CO3,碳酸铵和硫酸钙发生复分解反应生成(NH4)2SO4,反应方程式为(NH4)2CO3+CaSO4=CaCO3+(NH4)2SO4,然后过滤,得到沉淀碳酸钙,煅烧碳酸钙得到CaO,反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,将滤液分离提纯得到(NH4)2SO4,据此分析解答.
解答 解:CaSO4悬浊液中通入足量NH3,氨气极易溶于水,氨气和水反应生成NH3.H2O;然后向溶液中通入适量CO2,发生的反应为2NH3+H2O+CO2=(NH4)2CO3,碳酸铵和硫酸钙发生复分解反应生成(NH4)2SO4,反应方程式为(NH4)2CO3+CaSO4=CaCO3+(NH4)2SO4,然后过滤,得到沉淀碳酸钙,煅烧碳酸钙得到CaO,反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,将滤液分离提纯得到(NH4)2SO4,
A.二氧化碳不易溶于水,氨气极易溶于水,所以应该先通入氨气后通入二氧化碳,二者顺序不能颠倒,故A选;
B.为了钙离子完全转化为碳酸钙沉淀,加入的氨气应该过量,故B不选;
C.用二氧化碳和氨水制取碳酸铵,煅烧碳酸钙制取二氧化碳,所以二氧化碳能循环利用,故C不选;
D.根据N原子守恒知,生成1mol(NH4)2SO4至少消耗2 mol NH3,故D不选;
故选A.
点评 本题考查物质制备实验设计,为高频考点,明确流程图中发生的反应及基本操作是解本题关键,易错选项是A,要根据气体的溶解性强弱分析,题目难度不大.

M$→_{反应①}^{+X}$N$→_{反应②}^{+X}$Y.
| A. | M:N2 X:O2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:NO X:O2 |
| A. | 向CuSO4溶液中加入NaOH溶液得到的分散系 | |
| B. | 向水中加入食盐得到的分散系 | |
| C. | 向沸水中滴入饱和FeCl3溶液得到的红褐色液体 | |
| D. | 向NaOH溶液中通入CO2得到的无色溶液 |
 )甲酯并计算其产率.实验步骤如下:
)甲酯并计算其产率.实验步骤如下:Ⅰ.如图,在三颈烧瓶中加入6.9g (0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,以及约10mL甲苯(甲苯与
 水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
水形成的共沸物,其沸点为85℃;该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀后加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯5.3g.
常用物理常数如下:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是冷凝管,制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(2)实验中加入沸石的作用是防暴沸;
(3)加入甲苯的作用是将反应产生的水从反应体系中分离出来,使合成水杨酸甲酯反应的化学平衡向右移动,从而提高反应的产率.
(4)反应结束后,分离甲醇所采用操作的名称是蒸馏.
(5)洗涤操作中,前后两次水洗的目的分别是为了洗掉洗掉大部分硫酸和洗掉碳酸氢钠.
(6)在蒸馏操作中,仪器选择及安装都正确的是(填标号)b.

(7)本实验的产率为70%(保留两位有效数字).
| A. | 电子层序数越大,s原子轨道的形状相同、半径越大 | |
| B. | 在同一电子层上运动的电子,其自旋方向肯定不同 | |
| C. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| D. | 原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解 |

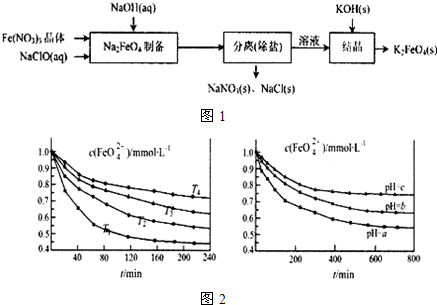
 工业上制取纯净的CuCl2•2H2O的主要过程是:
工业上制取纯净的CuCl2•2H2O的主要过程是: