题目内容
(12分)
Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。
(1)与NH3互为等电子体的分子、离子有 、 (各举一例)。
(2)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其他毒副作用低于顺铂。碳铂的结构如下图:
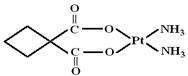
碳铂中含有的作用力有 (填字母)。
E.金属键 F.σ键 G.π键
(3)碳铂中C原子的杂化方式有 。
(4)铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
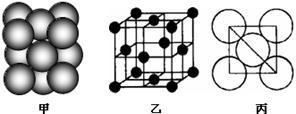
晶胞中铂(Pt)原子的配位数为 。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出A2+在基态时外围电子(价电子)排布式为 , B元素在周期表中的位置为 。
Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。
(1)与NH3互为等电子体的分子、离子有 、 (各举一例)。
(2)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其他毒副作用低于顺铂。碳铂的结构如下图:

碳铂中含有的作用力有 (填字母)。
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
(3)碳铂中C原子的杂化方式有 。
(4)铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

晶胞中铂(Pt)原子的配位数为 。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出A2+在基态时外围电子(价电子)排布式为 , B元素在周期表中的位置为 。
(1)PH3或AsH3、H3O+或CH3-
(2)ABCFG (3)sp3和sp2 (4)12
Ⅱ 3d6 第四周期Ⅷ族
(2)ABCFG (3)sp3和sp2 (4)12
Ⅱ 3d6 第四周期Ⅷ族
(1)1个NH3的电子数为10,核外电子总数为10个电子的微粒:
Ne、HF、H2O、NH3、CH4(分子类),
Na+、Mg2+、Al3+、NH4+、H3O+(阳离子类),
N3-、O2-、F-、OH-、NH2-、CH3-(阴离子类)
(2)不同原子间形成极性共价键,如C-H、C-O、N-H;
相同原子间形成非极性共价键,如C-C;
Pt形成配位键;碳氧双键中一个是σ键,另一个是π键;
(3)左侧4碳环上的C原子采用sp3杂化,碳氧双键上的C原子采用sp2杂化;
(4)看乙图:若以上层中心的铂原子为中心,分别在上、下、同平面上的面对角线上共12个;
(5)“既处于同一周期(同一横行)又位于同一族,且原子序数B比A多1”,故两者只能是第四周期,VIII族的元素,“基态B原子中含有三个未成对电子”,则B的价电子排布为3d74S2,B为钴元素(第四周期Ⅷ族);则A为铁元素(价电子排布为3d64S2),则Fe2+(比铁原子失去最外层的两电子)在基态时价电子排布式为3d6;
Ne、HF、H2O、NH3、CH4(分子类),
Na+、Mg2+、Al3+、NH4+、H3O+(阳离子类),
N3-、O2-、F-、OH-、NH2-、CH3-(阴离子类)
(2)不同原子间形成极性共价键,如C-H、C-O、N-H;
相同原子间形成非极性共价键,如C-C;
Pt形成配位键;碳氧双键中一个是σ键,另一个是π键;
(3)左侧4碳环上的C原子采用sp3杂化,碳氧双键上的C原子采用sp2杂化;
(4)看乙图:若以上层中心的铂原子为中心,分别在上、下、同平面上的面对角线上共12个;
(5)“既处于同一周期(同一横行)又位于同一族,且原子序数B比A多1”,故两者只能是第四周期,VIII族的元素,“基态B原子中含有三个未成对电子”,则B的价电子排布为3d74S2,B为钴元素(第四周期Ⅷ族);则A为铁元素(价电子排布为3d64S2),则Fe2+(比铁原子失去最外层的两电子)在基态时价电子排布式为3d6;

练习册系列答案
相关题目

 ,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
,已知断裂1 mol B—B吸收167 kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。 _________________________。
_________________________。
 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;