题目内容
(1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
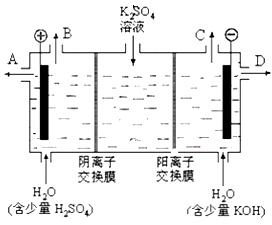
①该电解槽的阳极反应式为 。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
 CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
| 浓度 物质 | CO | H2O | CO2 | H2 |
| 起始浓度/(mol·L-1) | 2.0 | x | 0 | 0 |
| 平衡浓度/(mol·L-1) | 0.4 | 6.4 | 1.6 | 1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为 。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
(1)①增大 ②吸热 ③8.0 1
(2)①4OH--4e-=O2+2H2O (3分) ②D ③ 阴极氢离子放电,促进水的电离,氢氧根离子浓度增大(其它各2分)
(2)①4OH--4e-=O2+2H2O (3分) ②D ③ 阴极氢离子放电,促进水的电离,氢氧根离子浓度增大(其它各2分)
试题分析:本题考查化学反应的限度、化学平衡及电解原理的应用。(1)①恒容增大H2O (g)的物质的量,H2O (g)的浓度增大,平衡正向移动,则CO的转化率增大;②若升高温度能使化学平衡向正反应方向移动,结合温度对化学平衡的影响规律:升温平衡向吸热方向移动,则正反应是吸热反应;③分析表中数据可知,CO的浓度变化为1.6 mol·L-1,结合反应方程式知,H2O的浓度变化也为1.6 mol·L-1,H2O的起始浓度为8.0 mol·L-1,x=8.0;将表中各物质的平衡浓度代入该反应的平衡常数表达式K=c(H2)c(CO2)/c(CO)c(H2O)计算得K=1;(2)电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾,①根据题给装置图分析,左侧电极与外加电源的正极相连,作电解池的阳极,电极反应式为4OH--4e-=O2+2H2O;②右侧电极与外加电源的负极相连,作电解池的阴极,电极反应式为2H+ + 2e- = H2↑,该极区产生氢氧根,制得的氢氧化钾溶液从出口D导出;③通电开始后,阴极附近溶液pH会增大,原因是阴极氢离子放电,促进水的电离,氢氧根离子浓度增大

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
 N2+3H2 ΔH >0
N2+3H2 ΔH >0 N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
 CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
 H2+I2平衡体系增加压强使颜色变深
H2+I2平衡体系增加压强使颜色变深 xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<〈0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是