题目内容
【题目】硫酸工业的重要反应之一:2SO2(g)+O2(g)![]() 2SO3(g)下列叙述不正确的是( )
2SO3(g)下列叙述不正确的是( )
A.其他条件不变,升高温度可增大SO3的生成速率
B.使用合适的催化剂,是为了增大化学反应速率
C.该反应达到化学平衡状态时,SO2可100%转化为SO3
D.该反应达到化学平衡状态时,SO3的浓度不再改变
【答案】C
【解析】
A. 其他条件不变,升高温度,可以增大活化分子的百分数,增大SO3的生成速率,A正确;
B. 催化剂降低活化能,增大活化分子的百分数,所以使用合适的催化剂,是为了增大化学反应速率,B正确;
C. 该反应为可逆反应,反应不能进行到底,达到化学平衡状态时,SO2不可能100%转化为SO3,C错误;
D. 当反应达到化学平衡状态时,正逆反应速率相等,SO3的浓度不再改变,D正确;
故答案为:C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】I.(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。写出反应的离子方程式:_______________________。
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(T) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol·L-1·min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________________________。
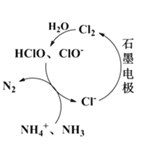
II.生活污水中的磷和氮主要以磷酸盐和铵盐形式存在。
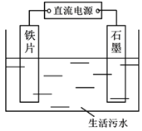
(1)除磷的原理如上图所示,利用电解法将PO43-转化为Fe3(PO4)2沉淀除去。铁作___________,(填“阴极”“阳极”),用化学用语表示产生Fe2+的主要过程:__________________________。
(2)有Cl-存在时,除氮原理如图所示,主要依靠电解产生的有效氯(HClO、ClO-)将NH4+或NH3氧化为N2.当pH<7时,主要发生HClO氧化NH4+的反应,其离子方程式为:_________________________________。