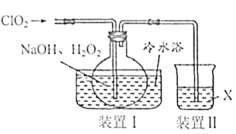
题目内容
【题目】下列图示与对应的叙述正确的是
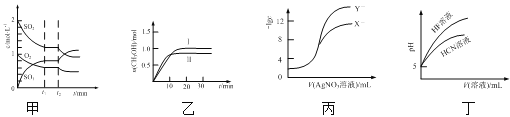
A.图甲表示一定条件下反应2SO2(g) + O2(g)![]() 2SO3(g)中各物质的物质的量浓度随时间的变化,说明t2时刻仅缩小了容器的容积
2SO3(g)中各物质的物质的量浓度随时间的变化,说明t2时刻仅缩小了容器的容积
B.图乙表示反应CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH<0在恒容密闭容器中,其他条件相同时,仅改变反应温度,n(CH3OH)随时间的变化,说明KⅠ>KⅡ
CH3OH(g) + H2O(g) ΔH<0在恒容密闭容器中,其他条件相同时,仅改变反应温度,n(CH3OH)随时间的变化,说明KⅠ>KⅡ
C.图丙表示用0.01 mol·L1 AgNO3溶液滴定浓度均为0.01 mol·L1的NaX、NaY混合溶液时,-lgc随AgNO3溶液体积的变化,说明Ksp(AgY) >Ksp(AgX)
D.图丁表示25℃时,加水稀释10 mL pH均为5的HF与HCN溶液时,溶液的pH随溶液体积的变化,说明Ka(HCN) >Ka(HF)
【答案】B
【解析】
A.若缩小容器体积,SO2、O2、SO3的浓度都会瞬间增大,而图示中SO2、O2的浓度瞬间不变,之后缓慢降低然后不变,SO3的浓度瞬间不变然后缓慢增大,所以t2时刻不可能是缩小容器的体积,故A错误;
B.据图可知I条件下反应达到平衡时间较长,反应速率较慢,平衡时n(CH3OH)较大,该反应为放热反应,所以TI<TII,放热反应温度越高,平衡常数越小,所以KⅠ>KⅡ,故B正确;
C.-lgc值越大,相应的离子浓度越小,据图可知当硝酸银溶液体积相同时,c(Yˉ)较小,所以AgY更难溶,所以Ksp(AgY)<Ksp(AgX),故C错误;
D.酸性越弱,同pH的酸溶液稀释相同的倍数,pH的变化越小,据图可知HF的酸性比HCN强,所以Ka(HCN)<Ka(HF),故D错误;
故答案为B。

【题目】(1)室温下,2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出1molC6H6完全燃烧的热化学方程式:______。
(2)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s)△H=+akJmol-1;C(s)+O2(g)=CO2(g)△H=-bkJmol-1,则2Fe(s)+
CO2(g)+2Fe(s)△H=+akJmol-1;C(s)+O2(g)=CO2(g)△H=-bkJmol-1,则2Fe(s)+![]() O2(g)=Fe2O3(s)的△H=________。
O2(g)=Fe2O3(s)的△H=________。
(3)已知几种化学键的键能如表所示:
化学键 | Cl—Cl | F—F | Cl—F |
键能/ kJ·mol—1 | 242 | 159 | 172 |
则反应Cl2(g)+3F2(g)![]() 2ClF3(g)的△H=_____________ kJ·mol-1。
2ClF3(g)的△H=_____________ kJ·mol-1。
(4)如图是乙烷、二甲醚燃烧过程中的能量变化图。
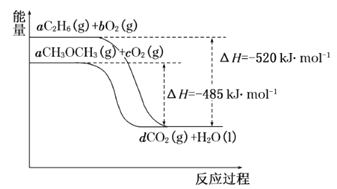
请回答下列问题:
①乙烷的燃烧热ΔH=_______kJ·mol-1。
②根据题图写出二甲醚完全燃烧时的热化学方程式__________。