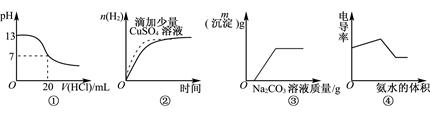
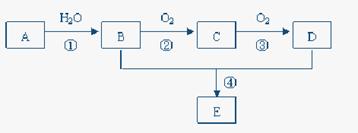
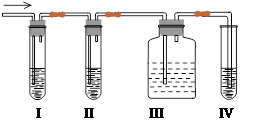
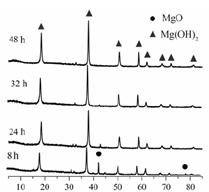
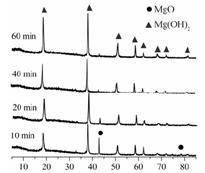
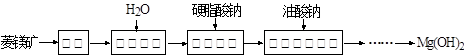题目内容
选择适当的试剂鉴别 、
、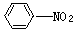 、 己炔、 乙酸四种物质,正确的是
、 己炔、 乙酸四种物质,正确的是
 、
、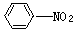 、 己炔、 乙酸四种物质,正确的是
、 己炔、 乙酸四种物质,正确的是| A.水 | B.溴水 | C.NaOH溶液 | D.酸性高锰酸钾溶液 |
B
试题分析:AC、
 、
、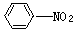 、 己炔和水都不反应,故错;
、 己炔和水都不反应,故错;D、
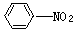 、 己炔和酸性高锰酸钾溶液都不反应,故错。
、 己炔和酸性高锰酸钾溶液都不反应,故错。故选B。
点评:本题考查有机物的鉴别,题目难度不大,本题注意三种物质的性质的差异性,当出现不同现象时才能鉴别。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
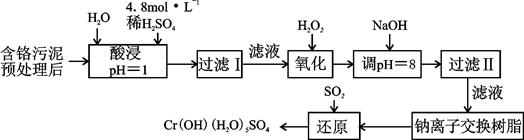
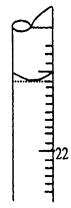
 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)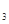 的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。