题目内容
【题目】烟气中通常含有高浓度SO2、氮氧化物及粉尘颗粒等有害物质,在排放前必须进行脱硫脱硝处理。
(1) 利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)=2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=________ kJ·mol-1。
(2) H2O2在催化剂αFeOOH的表面上,分解产生·OH。·OH较H2O2和O2更易与烟气中的NO、SO2发生反应。反应后所得产物的离子色谱如图1所示。
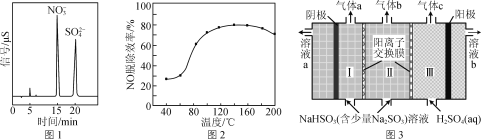
①写出·OH氧化NO的化学反应方程式:________。
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图2所示。升温至80 ℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是______________________________,温度高于180 ℃,NO的脱除效率降低的原因是________。
(3) 工业可采用亚硫酸钠作吸收液脱除烟气中的二氧化硫。应用双阳离子交换膜电解技术可使该吸收液再生,同时得到高浓度SO2,其工作原理如图3所示。
① SO2气体在________(填“Ⅰ”“Ⅱ”或“Ⅲ”)室生成。
②用离子方程式表示吸收液再生的原理:________。
(4) 新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能将烟气中SO2分解除去,若1 mol ZnFe2Ox与足量SO2生成1 mol ZnFe2O4和0.5 mol S,则x=________。
【答案】2a+2c-b 3·OH+NO=HNO3+H2O H2O2与催化剂的接触更好,产生更多的·OH,·OH浓度增大,与NO混合更充分 180 ℃以后,·OH分解成O2和H2O,NO的脱出效率下降 Ⅱ OH-+HSO3-=SO32-+H2O 3
【解析】
(1)根据盖斯定律进行计算;
(2) ①·OH氧化NO生成硝酸和水,据此写出化学方程式;
(3)根据电解池原理分析;
(4) 根据氧化还原反应中得失电子守恒计算。
(1)已知:①2NO(g)+O2(g)=2NO2(g);ΔH1=a kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH2=b kJ·mol-1
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH3=c kJ·mol-1
根据盖斯定律,由①×2+③×2-②得反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=ΔH1×2+ΔH3×2-ΔH2=(2a+2c-b)kJ·mol-1;
(2) ①·OH氧化NO生成硝酸和水,反应的化学反应方程式为:3·OH+NO=HNO3+H2O;
②当H2O2浓度一定时,升温至80 ℃以上,H2O2与催化剂的接触更好,产生更多的·OH,·OH浓度增大,与NO混合更充分,大量汽化的H2O2能使NO的脱除效率显著提高;温度高于180 ℃,·OH分解成O2和H2O,NO的脱出效率下降,NO的脱除效率降低;
(3) 工业可采用亚硫酸钠作吸收液脱除烟气中的二氧化硫。应用双阳离子交换膜电解技术可使该吸收液再生,同时得到高浓度SO2,根据图中信息可知阴极上氢离子得电子产生氢气,溶液中OH-浓度增大,和HSO3-反应生成SO32-,钠离子通过阳离子交换膜移向Ⅰ室,Na2SO3溶液再生;阳极是水电离出的OH-放电生成氧气,H+浓度增大,通过阳离子交换膜进入Ⅱ室,和Ⅱ室中的HSO3-生成亚硫酸,进而分解产生SO2;
① SO2气体在Ⅱ室生成;
②吸收液中氢氧根离子与亚硫酸根离子反应生成亚硫酸而再生,离子反应方程式为:OH-+HSO3-=SO32-+H2O;
(4) 根据氧化还原反应中得失电子守恒可知,N(铁失电子)=[3-(x-1)]×2×2=4×1=N(硫得电子),解得x=3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硅孔雀石是一种含铜矿石,含铜形态为![]() 和
和![]() ,同时含有
,同时含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质。以其为原料制取硫酸铜的工艺流程如图:
等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1)将硅孔雀石研磨成粉的目的:__________________;步骤①中稀硫酸与![]() 反应的化学方程式:__________________。
反应的化学方程式:__________________。
(2)双氧水的作用是__________________;滤渣![]() 的主要成分为__________________。
的主要成分为__________________。
(3)步骤②调节溶液![]() ,可以选用的试剂是______。
,可以选用的试剂是______。
A. CuO B. NaOH C.Al2O3 D. Cu(OH)2
(4)有关氢氧化物开始沉淀和完全沉淀的![]() 如下表:
如下表:
氢氧化物 |
|
|
|
|
开始沉淀的 | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的 | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节![]() ,所得滤渣
,所得滤渣![]() 的成分的化学式为____________,滤液
的成分的化学式为____________,滤液![]() 中除
中除![]() 外,还含有的金属阳离子是______。
外,还含有的金属阳离子是______。
(5)将滤液![]() 通过____________操作可得到五水硫酸铜晶体。测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果______(填“偏高”、“偏低”或“不变”)。
通过____________操作可得到五水硫酸铜晶体。测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果______(填“偏高”、“偏低”或“不变”)。