题目内容
【题目】下列关于铜、锌和稀硫酸组成的原电池的说法正确的是( )
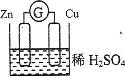
A.铜的表面没有气泡产生
B.电子从溶液中由锌向铜定向移动
C.该原电池利用电能使锌与硫酸发生反应
D.该原电池工作一段时间后,溶液中c(H+)减小
【答案】D
【解析】
试题分析:在原电池中,一般活泼金属做负极、失去电子、发生氧化反应(金属被氧化)、逐渐溶解(或质量减轻);不活泼金属(或导电的非金属)做正极、发生还原反应、有金属析出(质量增加)或有气体放出;电子从负极流出经过外电路流回正极,电流方向正好相反。因此:A.铜为正极,电极反应式:2H++2e-=H2↑。所以,铜表面有气泡产生,故A错误; B.电子不能从溶液中通过,应从锌经外电路流向铜,故B错误;C.该原电池是利用锌与硫酸发生反应产生电能,故C错误;D.该原电池工作时的总反应为:Zn+2H+= Zn2++ H2↑。所以一段时间后,溶液中c(H+)减小,故D正确。故选D。

练习册系列答案
相关题目