题目内容
前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为56;Y原子的M层p轨道有3个未成对电子;Z原子的M层p轨道有4个电子;W原子的L层电子数与最外层电子数之比为8:1,其d轨道中的电子数与最外层电子数之比为5:1.
(1)W原子结构示意图为______,W3+的电子排布式为______.
(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是______;中心原子的杂化方式为______;a分子的立体构型是______.
(3)Z最高价氧化物的水化物结构式为______,碳元素与Z按1:2的原子个数比形成的b,写出一种与b互为等电子体且含有Z原子的微粒的化学式______.
(4)Y与Z比较,电负性较大的______,1mol单质Y4与3mol氧气在一定条件下完全反应生成1mol化合物c,一个c分子中所含有的σ键数目为______.
(1)W原子结构示意图为______,W3+的电子排布式为______.
(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是______;中心原子的杂化方式为______;a分子的立体构型是______.
(3)Z最高价氧化物的水化物结构式为______,碳元素与Z按1:2的原子个数比形成的b,写出一种与b互为等电子体且含有Z原子的微粒的化学式______.
(4)Y与Z比较,电负性较大的______,1mol单质Y4与3mol氧气在一定条件下完全反应生成1mol化合物c,一个c分子中所含有的σ键数目为______.
Y 原子的M层p轨道有3个未成对电子,则原子核外电子排布为1s22s22p63s23p3,应为P元素,Z原子的M层p轨道有4个电子,原子核外电子排布为1s22s22p63s23p4,应为S元素,W原子的L层电子数与最外层电子数之比为8:1,则最外层电子数为1,其d轨道中的电子数与最外层电子数之比为5:1,说明d轨道有5个电子,原子序数为24,应为Cr元素,核电荷数之和为56,则X的核电荷数为56-15-16-24=1,应为H元素,
(1)W为Cr,原子核外有4个电子层,最外层电子数为1,次外层电子数为13,原子结构示意图为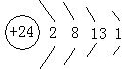 ,W3+的电子排布式为1s22s22p63s23p63d3,故答案为:
,W3+的电子排布式为1s22s22p63s23p63d3,故答案为: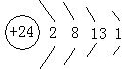 ;1s22s22p63s23p63d3;
;1s22s22p63s23p63d3;
(2)Y可与X形成只含一个中心原子的共价化合物a,应为PH3,电子式为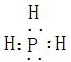 ,P形成3个δ键,且有1个孤电子对,为sp3杂化,为三角锥形分子,
,P形成3个δ键,且有1个孤电子对,为sp3杂化,为三角锥形分子,
故答案为: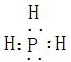 ;sp3;三角锥形;
;sp3;三角锥形;
(3)Z为S元素,最高价氧化物的水化物为H2SO4,为二元酸,结构式为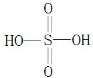 ,碳元素与Z按1:2的原子个数比形成的b,应为CS2,含有3个原子,各原子最外层电子数为16,与b互为等电子体且含有Z原子的微粒的化学式可为SCN-或COS,故答案为:
,碳元素与Z按1:2的原子个数比形成的b,应为CS2,含有3个原子,各原子最外层电子数为16,与b互为等电子体且含有Z原子的微粒的化学式可为SCN-或COS,故答案为: ;SCN-或COS;
;SCN-或COS;
(4)P和S相比较,电负性较大的是S,1mol单质Y4与3mol氧气在一定条件下完全反应生成1mol化合物c,应为P4O6,结构式为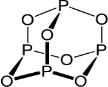 ,由结构式可知含有12个σ键,
,由结构式可知含有12个σ键,
故答案为:S;12.
(1)W为Cr,原子核外有4个电子层,最外层电子数为1,次外层电子数为13,原子结构示意图为
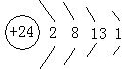 ,W3+的电子排布式为1s22s22p63s23p63d3,故答案为:
,W3+的电子排布式为1s22s22p63s23p63d3,故答案为: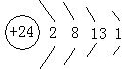 ;1s22s22p63s23p63d3;
;1s22s22p63s23p63d3;(2)Y可与X形成只含一个中心原子的共价化合物a,应为PH3,电子式为
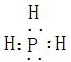 ,P形成3个δ键,且有1个孤电子对,为sp3杂化,为三角锥形分子,
,P形成3个δ键,且有1个孤电子对,为sp3杂化,为三角锥形分子,故答案为:
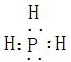 ;sp3;三角锥形;
;sp3;三角锥形;(3)Z为S元素,最高价氧化物的水化物为H2SO4,为二元酸,结构式为
 ,碳元素与Z按1:2的原子个数比形成的b,应为CS2,含有3个原子,各原子最外层电子数为16,与b互为等电子体且含有Z原子的微粒的化学式可为SCN-或COS,故答案为:
,碳元素与Z按1:2的原子个数比形成的b,应为CS2,含有3个原子,各原子最外层电子数为16,与b互为等电子体且含有Z原子的微粒的化学式可为SCN-或COS,故答案为: ;SCN-或COS;
;SCN-或COS;(4)P和S相比较,电负性较大的是S,1mol单质Y4与3mol氧气在一定条件下完全反应生成1mol化合物c,应为P4O6,结构式为
 ,由结构式可知含有12个σ键,
,由结构式可知含有12个σ键,故答案为:S;12.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目