题目内容
在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是
A.2 c1>c3 B.a + b=92.4 C.2P1<P3 D.α1 +α3=1
 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强 | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A.2 c1>c3 B.a + b=92.4 C.2P1<P3 D.α1 +α3=1
B
试题分析:A、丙可以看作是两个甲容器平衡后再放入同一个容器中,若平衡不移动,则有2 c1=c3,但是放入同一个容器中后,平衡正向移动,导致2 c1<c3,错误;B、从二个方向开始的反应达到平衡时,应该有a + b=92.4,正确;C、因为是同温同体积的条件,所以压强比等于物质的量的比,丙的情况可以理解为两个甲分别达到平衡后再充在一个容器中,假如平衡不移动,则压强正好是二倍,但是随着压强的增大,平衡正向移动,导致物质的量减少,所以有2P1>P3错误;D、在反应容器甲中,反应物是氮气和氢气,在反应容器乙中,反应物是氨气,达到平衡时有α1 +α2=1,但对于丙容器来讲,相当于乙中的反应物的二倍,转化是降低的,也就是说α2>α3,因此有α1 +α3<1,错误。

练习册系列答案
相关题目
 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。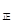 v
v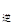 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____ 。 2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )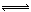 zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是
zC(g)。达到平衡后,测得A气体的浓度为0.5mol/L。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L。下列叙述正确的是 2NO2(g) △H<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达平衡状态且V(正)>V(逆)的点是
2NO2(g) △H<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达平衡状态且V(正)>V(逆)的点是
 M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
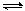
 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是