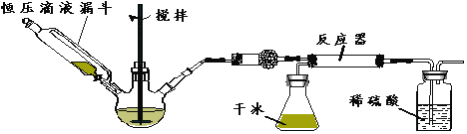
题目内容
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。
【答案】 能量 245 AC ab Zn- 2e-= Zn2+ 1 铜极 锌极
【解析】(1) 根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着能量变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是930 kJ-436 kJ-249 kJ =245kJ;(2)能设计成原电池的反应通常是放热反应,且必须是能自发进行的氧化还原反应,A.Fe+2FeCl3=3FeCl2是自发进行的氧化还原反应,能设计成原电池,故选;B.SO3+H2O=H2SO4不是氧化还原反应,所以不能设计成原电池,故不选;C、CH4+2O2![]() CO2+2H2O是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;D、Ba(OH)2+H2SO4=BaSO4+2H2O不是氧化还原反应,所以不能设计成原电池,故不选;答案选AC;(3) ①在该原电池中,Zn比Cu活泼,故Zn作负极,Cu作正极,a.电流计指针偏转,故正确;b. Cu作正极,正极反应为2H++2e-=H2↑,故正确;c.H+向正极移动,故错误;d.电子由Zn流出经导线流向Cu,电流由Cu经导线流向Zn,故错误;实验报告中记录合理的是ab;②负极反应为Zn-2e-=Zn2+;③若有1mol电子流过导线,则理论上产生产生0.5 mol H2,H2的质量为1g;④将稀H2SO4换成CuSO4溶液,正极铜电极上析出铜,质量增加的是铜极;在溶液中SO42-向负极锌极移动。
CO2+2H2O是放热反应且能自发的进行氧化还原反应,所以能设计成原电池,故选;D、Ba(OH)2+H2SO4=BaSO4+2H2O不是氧化还原反应,所以不能设计成原电池,故不选;答案选AC;(3) ①在该原电池中,Zn比Cu活泼,故Zn作负极,Cu作正极,a.电流计指针偏转,故正确;b. Cu作正极,正极反应为2H++2e-=H2↑,故正确;c.H+向正极移动,故错误;d.电子由Zn流出经导线流向Cu,电流由Cu经导线流向Zn,故错误;实验报告中记录合理的是ab;②负极反应为Zn-2e-=Zn2+;③若有1mol电子流过导线,则理论上产生产生0.5 mol H2,H2的质量为1g;④将稀H2SO4换成CuSO4溶液,正极铜电极上析出铜,质量增加的是铜极;在溶液中SO42-向负极锌极移动。

【题目】化学反应的快慢和限度对人类生产、生活有重要的意义。
(1)将影响化学反应速率的因素镇在空格处。
实例 | 影响因素 |
食物放在冰箱里延长保质期 | ①___ |
实验室将块状药品研细,再进行反应 | ②___ |
(2)某小组将酸性KMnO4溶液与H2C2O4(具有还原性)溶液混合,用反应中溶液紫色消失快慢的方法研究形响化学反应速率的因素。实验中酸性KMnO4溶液(0.0010mol/L)、H2C2O4溶液的用量均为4mL(忽略加入固体,溶液混合时体积的变化)。
①该反应中氧化剂与还原剂的物质的量之比为________。
②请帮助他们完成以下实验设计表:填写IV中的数据,并将实验目的补充完整。
实验编号 | 温度/K | 催化剂的用量/g | H2C2O4溶液的浓度/mol.L-1 | 实验目的 |
I | 298 | 0.5 | 0.010 | A.实验I和II探究____对反应速率的影响 B.实验I和III探究____对反应速率的影响 C.实验I和IV探究催化剂对反应速率的影响 |
II | 298 | 0.5 | 0.050 | |
III | 323 | 0.5 | 0.010 | |
IV | ____ | ____ | ____ |
③该小组同学对实验II进行了3次实验,测得以下数据:
实验编号 | 溶液退色所需时问t/min | ||
第1次 | 第2次 | 第3次 | |
II | 4.9 | 5.1 | 5.0 |
实验II中用KMnO4表示该反应的平均反应速率为____。
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。可通过H2S与CO2在高温下反应制得COS:H2S(g)+CO2(g) ![]() COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
实验 | 温度/℃ | 起始时 | 平衡时 | 平衡 常数 | |||
n(CO2)/mol | n(H2S)/mol | n(COS)/mol | n(H2O)/mol | n(COS)/mol | |||
1 | T1 | 0.200 | 0.200 | 0 | 0 | 0.0200 | K1 |
2 | T2 | 0.200 | 0.200 | 0 | 0 | n2 | K2 =1/36 |
3 | T2 | 0.400 | 0.400 | 0 | 0 | n3 | K3 |
下列判断不正确的是
A. K1=1/81
B. K2 = K3且n3= 2n2
C. 初始反应速率:实验3 gt; 实验2 > 实验1
D. 实验2中平衡时的c(COS)约为0.0286 mol·L-1