题目内容
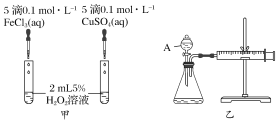
【题目】经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性如图甲可通过观察________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________________________,H2O2在二氧化锰催化作用下发生反应的化学方程式为____________________________________。
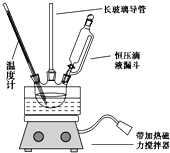
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是________。
【答案】反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰 ![]() 分液漏斗 收集40 mL气体所需要的时间
分液漏斗 收集40 mL气体所需要的时间
【解析】
首先明确实验目的:比较Fe3+和Cu2+对H2O2分解的催化效果;
(1)图甲:两试管中盛有等体积、等浓度的H2O2,分别滴入氯化铁、硫酸铜溶液,通过产生气泡的快慢即可比较Fe3+和Cu2+对H2O2分解的催化效果(保持其他条件相同,只改变催化剂);在探究Fe3+和Cu2+对H2O2分解的催化效果时必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理;
(2)“收集40 mL气体所需要的时间”即通过计算分别用Fe3+、Cu2+催化时生成O2的速率,来定量比较Fe3+和Cu2+对H2O2分解的催化效果;
(1)该反应中产生气体,所以可根据生成气泡的快慢判断;氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰;双氧水在二氧化锰作用下生成水和氧气,所以反应方程式为![]() ,
,
因此,本题正确答案是:反应产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;![]() ;
;
(2) 由图可以知道,A为分液漏斗;定量比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过测定产生40 mL的气体所需的时间来比较。产生40 mL的气体所需的时间越短,则催化效果越好,
因此,本题正确答案是:分液漏斗;收集40mL气体所需要的时间。

 名校课堂系列答案
名校课堂系列答案【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1,平衡常数为K1,反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2,平衡常数为K2,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q1_____0(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=_____,Q1、Q2、Q3的关系式Q3=_____,可推断反应③是_____(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有_____.
A.缩小容器体积 B.扩大容器的体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
图甲中t2时刻改变的条件可能是_____,图乙中t2时刻改变的条件可能是_____.