题目内容
4.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子数均为10的分子X、Y、Z,下列叙述错误的是( )| A. | A、B、C、D能形成5种以上单质 | |
| B. | X、Y、Z三种化合物的熔沸点逐渐升高 | |
| C. | X、Y、Z的稳定性逐渐减弱 | |
| D. | B的气态氢化物能与其最高价含氧酸反应 |
分析 A、B、C、D四种短周期元素的原子半径依次减小,A与C核电荷数之比为3:4,两元素有Li和Be、C和O、F和Mg(Mg原子半径大于F)、Mg和S,D能分别与A、B、C形成10电子的分子X、Y、Z,考虑10电子微粒,D为H元素,A为C元素,B为N元素,C为O元素,X、Y、Z分别为CH4、NH3、H2O,结合元素周期律及物质性质解答.
解答 解:A、B、C、D四种短周期元素的原子半径依次减小,A与C核电荷数之比为3:4,两元素有Li和Be、C和O、F和Mg(Mg原子半径大于F)、Mg和S,D能分别与A、B、C形成10电子的分子X、Y、Z,考虑10电子微粒,D为H元素,A为C元素,B为N元素,C为O元素,X、Y、Z分别为CH4、NH3、H2O.
A.由于C元素有非常多的同素异形体金刚石、石墨、C60、C70等,氧元素只存在O2、O3等,上述四种元素形成的单质超过5种,故A正确;
B.NH3分子间形成氢键比CH4分子间作用力大,NH3沸点较高,水常温是液体,沸点最高,所以X、Y、Z三种化合物的熔、沸点逐渐升高,故B正确;
C.非金属性越强,氢化物越稳定,同周期随原子序数增大,非金属性增强,所以非金属性C<N<O,所以CH4、NH3、H2O的稳定性逐渐增强,故C错误;
D.B的气态氢化物为氨气,与其最高价含氧酸为硝酸,二者反应生成硝酸铵,故D正确,
故选:C.
点评 本题考查元素周期表及元素性质、元素周期律的有关知识,难度中等,推断元素是解题关键,A、C核电荷数关系是突破口,注意掌握常见10电子、18电子微粒.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
17. X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
 X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )
X、Y、Z、W四种短周期元素(其中只有一种是金属元素)在周期表中的相对位置如图所示.下列说法正确的是( )| A. | 简单离子的半径:X3+>Z3- | |
| B. | 元素Z的最外层电子可能为6 | |
| C. | 元素Y的最高价氧化物的水化物可能是强酸 | |
| D. | 元素W的最高价氧化物的水化物属于共价化合物 |
18.传感器可以检测空气中SO2的含量,传感器工作原理如图所示.下列叙述中正确的是( )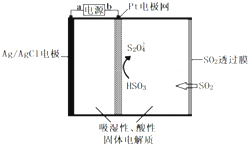

| A. | b为电源的正极 | |
| B. | 负极反应式 Ag-e-+Cl-═AgCl | |
| C. | 当电路中电子转移为5×10-5 mol时,进入传感器的SO2为 1.12 mL | |
| D. | 阴极的电极反应式是:2HSO3-+2H++2e-═S2O42-+2H2O |
12. 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图,下列说法中不正确的是( )
 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型,如图,下列说法中不正确的是( )| A. | 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多 | |
| B. | 分子中碳原子的化学环境有2种 | |
| C. | 分子中的氢原子分布在两个互相垂直的直线上 | |
| D. | 分子中有C-C键,也有C=C键 |
19.欲使混合物中的CuSO4•5H2O、NH4Cl、SiO2分离开,其必要的实验操作是( )
| A. | 升华 溶解 过滤 蒸发 | B. | 溶解 过滤 萃取 分液 | ||
| C. | 加热 溶解 过滤 结晶 | D. | 溶解 过滤 分馏 结晶 |