题目内容
【题目】(1)3.6g H2O物质的量为 mol ,约含有 个电子;与3.6g H2O所含H个数相同的CH4 的质量是 ,标准状况下体积约是 。
(2)标准状况下,容积为VmL的烧瓶内充满NH3,设NA代表阿伏加德罗常数的数值。
①标准状况下NH3的密度是 ,烧瓶内氢原子总数是 。
②已知NH3极易溶于水,所得溶液称为氨水(溶质为NH3)。用烧瓶中的NH3做喷泉实验,水充满烧瓶,所得溶液密度为d g/mL,假设NH3没有损耗,所得溶液物质的量浓度为 mol/L,溶质的质量百分数为 。
③标准状况下该烧瓶若充满H2时总质量为a g ,则充满NH3时烧瓶总质量为 g。
【答案】(1)0.2;1.204×1024 ;1.6g ;2.24L
(2)① 0.76g /L ![]() ②
②![]() 或0.045
或0.045 ![]() ③
③ ![]()
【解析】
试题分析:(1)3.6g H2O物质的量为3.6g÷18g/mol=0.2mol ,约含有0.2×10×NA个电子;其中氢原子的物质的量是0.4mol,则与3.6g H2O所含H个数相同的CH4的物质的量是0.4mol÷4=0.1mol,质量是0.1mol×16g/mol=1.6g,标准状况下体积约是0.1mol×22.4L/mol=2.24L。
(2)①标准状况下NH3的密度是![]() =0.76g/L,烧瓶内氢原子总数是
=0.76g/L,烧瓶内氢原子总数是![]() =
=![]() 。
。
②假设NH3没有损耗,所得溶液物质的量浓度为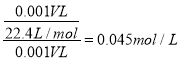 ,根据
,根据![]() 可知溶质的质量百分数为
可知溶质的质量百分数为![]() 。
。
③设烧瓶质量为Mg,标准状况下该烧瓶若充满H2时总质量为a g ,则根据阿伏加德罗定律可知![]() ,解得m=
,解得m=![]() 。
。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目

